Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
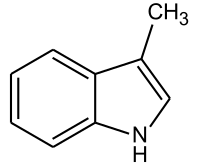
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Skatol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C9H9N | |||||||||||||||
| Kurzbeschreibung |
weiße bis bräunliche Kristalle mit unangenehmem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 131,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
265–266 °C[2] | |||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (450 mg·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Das Skatol (von altgriechisch σκῶρ skṓr [Genitiv σκατός skatós] „Kot“) ist eine sehr intensiv und unangenehm riechende Indolverbindung. Der Geruch von Fäkalien ist vor allem auf Skatol zurückzuführen.[4]
Skatol kommt im menschlichen und tierischen Kot, im Mist (bis zu 0,1 %), im Sekret der Zibetkatze und in sehr vielen Pflanzen als Bestandteil des Blütenduftes vor. Auch das Fleisch unkastrierter Eber enthält Skatol.[5]
Fleisch besteht aus Eiweißen, die Bausteine der Eiweiße sind die Aminosäuren. Eine dieser Aminosäuren ist Tryptophan, eine essenzielle Aminosäure, die vom menschlichen Organismus nicht selbst gebildet werden kann, sondern mit der Nahrung aufgenommen werden muss. Die Umwandlung der Aminosäure beispielsweise bei der Verdauung in verschiedene Abbauprodukte, die teilweise vom Körper aufgenommen, teilweise ausgeschieden werden, besorgen Enzyme. Skatol ist neben Indol eines der Abbauprodukte von Tryptophan. Die Verwandtschaft von Tryptophan, Indol und Skatol ist an der allen drei gemeinsamen Ringstruktur zu erkennen. Da Tryptophan besonders häufig in tierischen Proteinen (also auch im Muskelfleisch) vorkommt, ist Skatol bei häufigem Fleischverzehr in entsprechend größerer Menge im Stuhl vorhanden.
Skatol kann auf chemischem Wege aus Indol hergestellt werden. Da eine direkte Methylierung von Indol jedoch das 1-Methylindol (syn.: N-Methylindol) liefern würde, muss zunächst die N–H-Gruppe mit einer Schutzgruppe versehen werden. Es werden z. B. Trialkylsilyl-Schutzgruppen bevorzugt, da sie bei der nachfolgenden Deprotonierung (bzw. Lithiierung) mit Alkyllithium-Verbindungen resistent sind. Nach Umsetzung mit Methyliodid wird die Schutzgruppe wieder entfernt und man erhält Skatol.
Skatol bildet weiße Kristalle. Es reagiert heftig mit starken Oxidationsmitteln, starken Säuren, Carbonsäurechloriden und Säureanhydriden.
Die Geruchsschwelle für Skatol in Luft ist beim Menschen außerordentlich niedrig. In der Literatur finden sich dafür Werte von 1,5 µg·m−3,[6] 0,0005 bis 6,4 µg·m−3,[7] und 0,0004 µg·m−3[8]. In Wasser beträgt der Geruchsschwellenwert 10 µg·l−1,[9] in Sonnenblumenöl 15,6 ppb.[10]
Skatol hat in hoher Verdünnung einen reinen, nebengeruchsarmen Geruch nach Rosen und wird in Spuren in der Parfümerie verwendet.[11]
Skatol zieht manche Insektenarten, darunter Mücken und manche Prachtbienen, an und wird daher in Labor- und Feldstudien als Lockmittel verwendet.[12][13]
Der Nachweis von Skatol kann in einfachen Untersuchungsgütern mittels Headspace-Gaschromatographie erfolgen.[14] In komplexeren Untersuchungsmaterialien kann nach hinreichender Probenvorbereitung die qualitative und quantitative Bestimmung von Skatol durch Kopplung der Gaschromatographie mit der Massenspektrometrie vorgenommen werden.[15][16][17] Auch die Kopplung der UHPLC mit der Massenspektrometrie kommt zum Einsatz bei komplexerem Untersuchungsgut.[18]