Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Disprosi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
66Dy
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Blanc platejat  Línies espectrals del disprosi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Disprosi, Dy, 66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Lantànids | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 162,500 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f10 6s2 2, 8, 18, 28, 8, 2 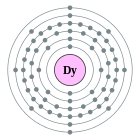
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
8,540 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
8,37 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.680 K, 1.407 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 2.840 K, 2.562 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 11,06 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 280 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 27,7 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 3, 2, 1 (òxid bàsic feble) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,22 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 573,0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.130 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.200 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 178 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 192±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic a 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (t, a,) (α. poli) 926 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 10,7 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (t, a,) (α. poli) 9,9 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 2.710 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | (forma α) 61,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | (forma α) 24,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | (forma α) 40,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | (forma α) 0,247 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 540 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 500 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7429-91-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del disprosi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
El disprosi és un element químic de la taula periòdica el símbol del qual és Dy i el seu nombre atòmic és 66. Pertany a la sèrie dels lantanoides. És un metall prou tou per a poder ser tallat amb un ganivet, dúctil i mal·leable, de lluïssor metàl·lica argentada. S'empra en la fabricació d'imants per a discs durs d'ordinadors i altres dispositius, en aliatges com el terfenol-D d'elevada magnetoresistència, per absorbir neutrons als reactors nuclears i en la fabricació de làmpades halògenes.

En el 1886, en el seu laboratori personal de París, el químic francès Paul-Émile Lecoq de Boisbaudran (1838-1912) analitzà espectroscòpicament una mostra d’òxid d’holmi o hòlmia, terra rara descrita pel suec Per Teodor Cleve (1840-1905) en el 1879. L’anàlisi li feia pensar en l’existència d’algunes impureses no atribuïbles a cap dels elements químics descrits. Lecoq tenia present que l’holmia de Cleve era el mateix compost que el suís Jacques-Louis Soret (1827-1890) el 1878 havia designat com a terra X,[1][2] i era parcialment identificable amb la “philippine” postulada pel suís Marc Delafontaine (1838-1911) el mateix 1878.[3] La terra X de Soret era caracteritzada per les següents línies espectrals:
|
|
Lecoq emprengué un penós procés de precipitacions fraccionades. A la solució àcida d’òxid d’holmi, hi afegia quantitats variables d’amoníac i de sulfat de potassi. Després de centenars de rondes de fraccionament, Lecoq comprovà com distingia dues tipologies de fraccions:
Lecoq deduïa que l’hòlmia no era pas una terra homogènia, i que darrere hi havia d’haver, si més no, dos radicals o elements.[4]
L’abril del 1886 Lecoq publicà una nota[5] on proposà conservar el nom d’holmi (Ho) per a l’element responsable de les bandes de 640,4 nm i de 536,3 nm. Alhora, les bandes 753 nm i 451,5 calia atribuir-les a un altre element, per al qual proposà el nom de disprosi i el símbol químic Dy,[4] per la paraula grega δυσπρόσιτος, dispróssitos, que vol dir ‘difícil d'obtenir’. Després de moltes etapes, aconseguí una petita mostra de l'element.[6]
L'element fou aïllat per primera vegada per un altre químic francès, Georges Urbain (1872-1938), el 1906, però no se'n pogué obtenir una mostra pura fins molts anys després. Quan al voltant de 1950 es desenvolupà la cromatografia de bescanvi iònic, un procés que separa ions i molècules polars, finalment es pogué separar el disprosi i aconseguir una mostra pura. Aquest procés fou emprat pels científics Frank H. Spedding (1902-1984) i J.L. Dye a la Universitat Estatal d'Iowa el 1950, que finalment pogueren aïllar una mostra pura de disprosi.[7]

Quant a l'abundància dels elements a l'escorça terrestre el disprosi ocupa la posició 42, amb una concentració mitjana de 6 ppm.[8] Es troba en molts minerals en proporcions molt baixes juntament amb altres lantanoides. Entre els minerals que en tenen més hi ha la churchita-(Dy) amb un 17,17%, la agardita-(Dy) amb un 9,00 %, la yftisita-(Y) amb un 6,47 % i la adamsita-(Y) amb un 4,72 %.[9]

S'obté, malgrat estar-hi en menors proporcions, a partir dels minerals monazita i bastnäsita , juntament amb altres lantanoides. El metall s'extreu com a subproducte del procés d'extracció de l'itri. Metalls indesitjats s'eliminen per separació magnètica i per flotació. Després per aïllar-lo d'altres lantanoides s'empren resines de bescanvi iònic. A continuació s'obté clorur de disprosi(III) o fluorur de disprosi(III) que, per reducció amb calci o amb liti, donen el disprosi metàl·lic:[10]
La producció mundial se situa al voltant de les 1 700 tones anuals d'òxid de disprosi(III). De cara al futur, es preveu un creixement de la demanda de disprosi impulsat per l'augment global de la demanda de vehicles elèctrics, l'energia neta, l'eficiència energètica i l'automatització.[11]
El disprosi és un metall de la sèrie dels lantanoides, té una densitat de 8,551 g/cm³, un punt de fusió de 1 412 °C i un punt d'ebullició de 2 567 °C. És dúctil i mal·leable. Té una lluïssor metàl·lica platejada. És prou tou per a poder ser tallat amb un ganivet. És relativament estable a temperatura ambient.[12] La seva configuració electrònica és [Xe] (4f )¹⁰(6s)².[13]
S'han descrit tres formes al·lotròpiques. A temperatura ambient hom troba la fase α constituïda per un empaquetatge compacte hexagonal. Si es refreda per sota els 90 K es transforma en la fase β, que té estructura cristal·lina ortoròmbica. La fase γ té estructura cúbica centrada en el cos i hom pot trobar-la a 1,38 °C.[13] El metall té un elevat paramagnetisme per sobre els 180 K (−93 °C); és antiferromagnètic entre uns 90 (−183 °C) i 180 K i ferromagnètic per sota de 90 K.[13]
El disprosi s'oxida lentament exposat a l'aire i es crema fàcilment per formar òxid de disprosi(III), blanc, l'únic òxid conegut:

És força electropositiu i generalment és trivalent, malgrat que s'han descrit alguns composts on actua amb nombre d'oxidació +2. Reacciona lentament amb aigua freda i força ràpidament amb aigua calenta per formar hidròxid de disprosi(III):
Reacciona amb tots els halògens donant els corresponents halogenurs de disprosi(3+), alguns dels quals són acolorits:
Es dissol fàcilment en àcid sulfúric diluït per formar solucions que contenen els cations disprosi(3+) com a complexos de color groc verdós.[14]

Altres composts de disprosi(3+) són: el nitrat de disprosi(III)—aigua(1/5) , el carbonat de disprosi(III)—aigua(1/4) , l'acetat de disprosi(III)—aigua(1/4) , l'hidrur de disprosi(III) , el sulfur de disprosi(III) , el tel·lurur de disprosi(III) , el tetraborur de disprosi , el nitrur de disprosi o el silicur de disprosi .[12]
La majoria dels composts del disprosi són compostos de disprosi(3+), però també n'hi ha uns pocs de disprosi(2+) com el clorur de disprosi(II) i el iodur de disprosi(II) , de colors foscs.[12]
Els isòtops naturals són tots estables i tenen els nombres màssics 164 (abundància natural 28,3 %), 162 (25,5 %), 163 (24,9 %), 161 (18,9 %), 160 (2,33 %), 158 (0,10 %) i 156 (0,06 %). Exclosos els isòmers nuclears, es coneixen un total de 29 isòtops radioactius de disprosi. Oscil·len en nombre màssic des del 138 fins al 173. El menys estable és el disprosi 139 (semivida de 0,6 segons), i el més estable és el disprosi 154 (semivida de 3,0 × 106 anys).[13]


El disprosi, juntament amb el neodimi i el terbi, és utilitzat en els imants de neodimi en què part del neodimi, més del 6 %, se substitueix per disprosi. D'aquesta manera s'eleva la temperatura de Curie i la coercitivitat, incrementant així el rendiment de l'imant a altes temperatures.[13] Aquests imants tenen aplicacions cada vegada més importants en els motors elèctrics dels vehicles híbrids i en els aerogeneradors elèctrics, dels quals milloren el rendiment. També és un dels components principals dels imants dels discos durs dels ordinadors.[15]
El disprosi tendeix a millorar la resistència dels acers a la corrosió. El disprosi, el ferro i el terbi formen l'aliatge amb la magnetoresistència més potent que existeix a temperatura ambient, el terfenol-D , usat en sistemes de sonar naval i en sensors magnetomecànics.[15]
Té una gran capacitat d'absorció de neutrons, raó per la qual s'utilitza en la fabricació de les barres de control dels reactors nuclears, que tenen com a funció regular la reacció nuclear en cadena que produeix calor.[15]
El iodur de disprosi i el bromur de disprosi es fan servir en la fabricació de làmpades halògenes d'alta intensitat anomenades làmpades MSR (Medium Source Rare Earth Lamps) per a il·luminació i projecció, perquè en millora la qualitat de l'espectre, sobretot en la franja dels vermells.[15]
El disprosi no té cap funció biològica. Les sals de disprosi solubles són lleugerament tòxiques per ingestió, mentre que les sals insolubles no són tòxiques. A partir de proves de toxicitat amb ratolins es calculà que caldria una dosi de 500 grams, o més, per posar en risc la vida d'una persona.[16]
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||