Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.

La configuració electrònica és la distribució dels electrons en els orbitals atòmics al voltant del nucli atòmic d'un àtom o en els orbitals moleculars d'una molècula.
Segons el model atòmic de Schrödinger els electrons s'interpreten com a ones que poden tenir diferents funcions d'ona. D'aquestes funcions d'ona, anomenades orbitals atòmics, se'n pot obtenir diferents propietats dels electrons, com ara la seva energia o la zona on és més o menys probable trobar-los. La configuració electrònica d'un àtom indica quins orbitals atòmics ocupen els electrons de l'escorça atòmica.[1]
Els diferents orbitals atòmics venen caracteritzats per tres nombres quàntics:

Per altra banda, ele electrons tenen un altre nombre quàntic, el nombre quàntic d'espin, que pot adoptar dos valors ( = –1/2 o +1/2).[1]
| nom | símbol | significat orbital | range dels valors | Exemple |
|---|---|---|---|---|
| Nombre quàntic principal | orbital | |||
| Nombre quàntic azimutal | suborbital | per :
| ||
| Nombre quàntic magnètic | desplaçament de l'energia | per :
| ||
| Nombre quàntic d'espín | espín | només: |

S'utilitza una notació estàndard per a descriure les configuracions electròniques dels àtoms. L'ordre és el del nombre quàntic principal (1, 2, 3...) i les subcapes en ordre d'energia creixent (). En aquesta notació, cada subcapa és descrita amb la notació on;
Per a simplificar sovint la configuració fins al gas noble anterior se simbolitza posant el símbol del gas noble dins d'uns claudàtors. Les configuracions electròniques de l'oxigen i del potassi s'escriuen:[1]
El principi d'Aufbau (del terme alemany Aufbauprinzip, «principi de construcció») és una racionalització de la distribució dels electrons entre els nivells d'energia en els estats fonamentals (més estables) dels àtoms. Aquest principi, formulat pel físic danès Niels Bohr cap a l'any 1920, és una aplicació de les lleis de la mecànica quàntica a les propietats dels electrons sotmesos al camp elèctric creat per la càrrega positiva del nucli d'un àtom i la càrrega negativa dels altres electrons que estan lligats al nucli. La construcció assenyalada pel nom d'aquest principi és un procés hipotètic en el qual els electrons són considerats com si entraren, un per un, en aquest camp elèctric i prenent les seves condicions més estables respecte a ell.[2]

El número quàntic principal determina l'energia dels nivells energètics. Com menor sigui , més baix és el nivell. Per tant, el nivell més baix és el corresponent a = 1. Dins d'un mateix nivell l'ordre d'energies segueix l'ordre del nombre quàntic secundari. Tanmateix, a mesura que s'omplen els nivells els subnivells més baixos d'un determinat nivell queden per sota dels subnivells més alts del nivell immediatament inferior. Per aquesta raó, no és obvi la distribució d'electrons per subnivells.
La regla de Madelung, o de Madelung-Klechkovsky, fou publicada el 1926 pel físic alemany Erwin Madelung (1881-1971) i fou justificada teòricament el 1951 pel físic soviètic Vsevolod Klechkovsky (1900-1972).[3][4] Aquesta regla diu que els electrons ocupen els orbitals seguint l'ordre creixent de la suma de números quàntics principal i secundari , i si coincideixen, s'ocupa primer el d' inferior. No obstant això, encara que és vàlida per a la majoria d'àtoms no sempre es compleix.[5]

| (màxim 2e-) | 1r | 2n | 4t | 6è | 9è | 12è | 16è | 20è | |
| (màxim 6e-) | 3r | 5è | 8è | 11è | 15è | 19è | 24è | ||
| (màxim 10e-) | 7è | 10è | 14è | 18è | 23è | ||||
| (màxim 14e-) | 13è | 17è | 22è | ||||||
| (màxim 18e-) | 21è |
El diagrama de Moller, publicada el 1963[6] pel químic estatunidenc George T. Moeller (1913-1997), és una regla mnemotècnica gràfica de la regla de Madelung que consisteix a escriure els orbitals d'un mateix nivell en files i en columnes els de diferents nivells per ordre creixent. A l'hora d'omplir els orbitals s'ha de seguir l'ordre de les diagonals.
Es produeixen excepcions a la regla de Madelung degut a que les energies dels orbitals superiors d'un determinat nivell tenen energies semblants als inferiors del nivell immediatament superior. Una de les excepcions a la regla de Madelung es produeix en el bloc d de la taula periòdica en els elements que estan omplint els orbitals d i ja tenen ple l'orbital s del nivell superior. Si es pot deixar mig ocupats amb cinc electrons o completament ocupats, amb deu electrons, els orbitals d, un electró que a l'element anterior ocupava un orbital s n'ocupa un de d. També es dona aquesta excepció amb els lantanoides i actinoides que un electró que ha d'ocupar un orbital f quan els orbitals f estan mig ocupats, passa a ocupar un orbital d i així es pot continuar deixant mig ocupats els orbitals f amb set electrons. Per exemple en el crom i en el coure i en el gadolini:[7]
Els lantanoides i els actinoides també presenten l'excepció que no comencen a emplenar els orbitals 4f i 5f, respectivament, quan indica la regla de Madelung, sinó alguns elements després. És el cas del lantani i del ceri:[7]
| Element | Configuració | Element | Configuració | Element | Configuració | Element | Configuració |
|---|---|---|---|---|---|---|---|
| Crom | Niobi | Lantani | Actini | ||||
| Coure | Molibdé | Ceri | Tori | ||||
| Ruteni | Gadolini | Protoactini | |||||
| Rodi | Platí | Urani | |||||
| Pal·ladi | Or | Neptuni | |||||
| Argent | Curi |

El principi d'exclusió de Pauli, introduït pel físic austríac Wolfgang Pauli el 1925,[9] diu que en un sistema de fermions idèntics, com ara els electrons, no pot haver-n'hi dos en el mateix estat quàntic. Això equival a dir que dos electrons no poden tenir els mateixos quatre números quàntics. Per tant, aquest principi limita a dos els electrons que poden ocupar un orbital atòmic, ja que només hi ha dos valors possibles del nombre quàntic d'espin: +½ i –½.[7]
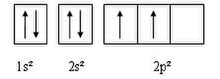
La regla de màxima multiplicitat, establerta empíricament pel físic alemany Friedrich Hund el 1925,[10][11] diu que quan hi ha electrons que poden ocupar orbitals de la mateixa energia no es poden aparellar fins que s'han ocupat tots els orbitals i amb espins paral·lels.

Les configuracions electròniques poden obtenir-se experimentalment a partir de la determinació de les energies d'ionització. El mètode més habitual per a la seva determinació és el de l'espectroscòpia fotoelectrònica, malgrat també es poden determinar amb el mètode d'impacte d'electrons.[12]
L'espectroscòpia fotoelectrònica consisteix en irradiar amb llum monocromàtica, de freqüència coneguda, una mostra en estat gasós de l'element químic estudiat. Les reaccions d'ionització que tenen lloc per a un element són:[12]
Els electrons més exteriors són els que es perden més fàcilment i l'energia necessària s'incrementa en baixar de subnivells i nivells energètics. Mitjançant un espectròmetre es mesura l'energia cinètica dels electrons que són emesos i és igual a la diferència d'energia del fotó incident i l'energia d'ionització :[12]
| Element | 1s | 2s | 2p | 3s | 3p | 3d | 4s |
|---|---|---|---|---|---|---|---|
| Potassi, K | 347 | 37,1 | 29,1 | 3,93 | 2,38 | 0,42 | |
| Calci, Ca | 390 | 42,7 | 34,0 | 4,65 | 2,90 | 0,59 | |
| Escandi, Sc | 433 | 48,5 | 39,2 | 5,44 | 3,24 | 0,77 | 0,63 |
A la següent taula d'energies d'ionització hom veu clarament al diferències d'energies dels nivells energètics atenent simplement a l'ordre de magnitud. Per exemple en el potassi l'energia dels nivell 1s és de 347 MJ/mol, la dels subnivells 2s i 2p, 37,1 i 29,1 MJ/mol; la dels nivells 3s i 3p, 3,93 i 2,38 MJ/mol; i la del nivell ocupat més alt, el 4s, 0,42 MJ/mol. Cal observar que el calci té els mateixos nivells i subnivells ocupats que el potassi, però les energies són un poc superiors degut a que té un protó més en el nucli atòmic la qual cosa fa disminuir l'energia dels orbitals atòmics.[12]
Per altra banda és interessant veure que l'energia d'ionització més baixa de l'escandi és la del subnivell 4s, completament ocupat per dos electrons, i no la del 3d ocupat amb un sol electró dels deu que hi caben. Malgrat en construir la configuració electrònica seguint el principi de l'Aufbau se situen primer els electrons 4s i després els 3d, aquest no és l'ordre d'energies. Les energies venen determinades pel nombre quàntic principal i en ionitzar-se sempre es perden els electrons més exteriors que són els del subnivell més alt.[12][8]
Els orbitals 3d són més compactes que els 4s, i com a resultat, qualsevol electró que entri en orbitals 3d experimentarà una repulsió mutua més gran. Així en el potassi i en el calci els electrons ocupen primer l'orbital 4s abans que el 3d. A l'escandi, com es veu en el procesos d'ionització, primer entra un electró a l'orbital 3d abans que en el 4s (el principi d'Aufbau indica on estan situats els electrons en àtoms neutres, no l'ordre de col·locació). El següent electró ocupa un orbital 4s, a poca energia del 3d, per evitar la repulsió. També el darrer electró va a l'orbital 4s, molt major que els 3d. Si hagués d'entrar un altre electró no ocuparia un orbital 4p, més alt d'energia, sinó que se situa en el 3d, malgrat la repulsió.[8]
Una cosa a tenir en compte és que la càrrega nuclear augmenta a mesura que avancem pels àtoms, i hi ha un conjunt complicat d'interaccions entre els electrons i el nucli atòmic, així com entre els mateixos electrons.[8]

Les propietats químiques d'un àtom depenen molt de com estan ordenats els electrons en els orbitals de més energia, anomenats de valència, a part d'altres factors com el radi atòmic, la massa atòmica, o l'accessibilitat d'altres estats electrònics.
Conforme es baixa en un grup d'elements, des del més lleuger al més pesant, els electrons més externs, en nivells d'energia més alts, i que per tant és més fàcil que participin en les reaccions químiques, estan en el mateix orbital, amb una forma semblant, però amb una energia i distància al nucli majors. Per exemple, el carboni i el plom tenen quatre electrons en els seus orbitals més externs.
A causa de la importància dels nivells energètics més exteriors, les diferents regions de la taula periòdica es divideixen en blocs, anomenant-se segons el nivell que es va ocupant: elements del bloc s, elements del bloc p, elements del bloc d i elements del bloc f, tal com es veu a la taula periòdica adjunta.

Si es forma un enllaç entre dos o més àtoms, segons la teoria dels orbitals moleculars, els orbitals atòmics superiors se superposen i formen orbitals moleculars. Si la superposició és frontal s'anomenen orbitals σ, i si és lateral orbital π. Per altra banda, en superposar-se dos orbitals atòmics se'n creen dos d'orbitals moleculars, un de més baixa energia, anoment enllaçant perquè afavoreix l'enllaç; i un antienllaçant perquè els electrons que l'ocupen tendeixen a separar els àtoms (aquests se simbolitzen amb una estrella com a superíndex a la dreta).[13]
L'ordre d'energies dels orbitals moleculars quan es combinen sobre l'eix z els orbitals atòmics dels nivells 1 i 2 són:[13]
També es poden combinar orbitals atòmics superiors seguint un esquema igual. El nombre d'electrons s'escriu igual que a la notació dels orbitals atòmics, a la part superior dreta.[13]
L'oxigen té una configuració electrònica dels electrons de valència , que són els únics a tenir en compte per a la configuració electrònica molecular. La notació per a la molècula de dioxigen és:[14]
Els darrers electrons estan situats en diferents orbitals moleculars antienllaçants seguint la regla de Hund, la qual cosa està d'acord amb l'observació experimental de que la molècula de dioxigen és paramagnètica.[14]