Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Etanol | |
|---|---|
 | |
| Xeneral | |
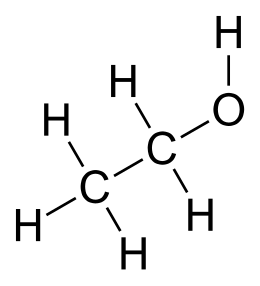
| Estructura química |
 |
| Fórmula química | C₂H₆O |
| SMILES canónicu | modelu 2D |
| MolView | modelu 3D |
| Propiedaes físiques | |
| Masa | 46,042 unidá de masa atómica |
| Densidá absoluta | 790±10 quilogramu por metru cúbicu |
| Puntu de fusión | −173±1 Grau Fahrenheit, −114 grau Celsius, −114,1 grau Celsius |
| Puntu d'ebullición | 173±1 Grau Fahrenheit, 79 grau Celsius, 78,29 grau Celsius |
| Sistema cristalinu | sistema cristalino monoclínico |
| Grupu puntual | monoclínico-domático |
| Grupu espacial | grupo espacial 7 |
| Índiz de refraición | 1,3611 |
| Velocidá del soníu | 1162±1 metru por segundu |
| Enerxía d'ionización | 10,47±0,01 electrón-voltiu |
| Capacidá calorífica | 13,444 xuliu por mol kelvin |
| Propiedaes termoquímiques | |
| Entalpía de formación | −277,6±0,1 quiloxuliu por mol, −234,8±0,1 quiloxuliu por mol |
| Entalpía de combustión | −1367 quiloxuliu por mol |
| Entropía molecular estándar | 160,7±0,1 xuliu por mol kelvin, 281,6±0,1 xuliu por mol kelvin |
| Peligrosidá | |
| Puntu d'inflamabilidá | 55±1 Grau Fahrenheit, 12 grau Celsius |
| Temperatura d'autoignición | 363 grau Celsius |
| Llímite inferior d'esplosividá | 3,3±0,1 porcentaxe en volume |
| Llímite superior d'esplosividá | 19±1 porcentaxe en volume |
| Identificadores | |
| IDLH | 6237±1 miligramu por metru cúbicu |
| 44±1 milímetru de mercuriu, 58 hectopascal | |
El compuestu químicu etanol, conocíu como alcohol etílico, ye un alcohol que preséntase en condiciones normales de presión y temperatura como un llíquidu incoloro ya inflamable con un puntu d'ebullición de 78,4 °C.
Miscible n'agua en cualquier proporción; a la concentración de 95 % en pesu forma un amiestu azeotrópicu.
La so fórmula química ye CH3-CH2-OH (C2H6O), principal productu de les bébores alcohóliques como'l vinu (alredor d'un 13 %), la cerveza (5 %), los llicores (hasta un 50 %) o los aguardientes (hasta un 70 %).[1]
L'etanol ye'l nome sistemáticu definíu pola Xunión Internacional de Química Pura y Aplicada, (IUPAC) n'inglés, nomenclatura de la química orgánica pa una molécula con dos átomos de carbonu (prefixu "et-"), que tien un únicu venceyu ente ellos (el sufixu "-anu" ), y un grupu xuníu-OH (sufixu "-ol").[2]
El prefixu de etilo foi acuñáu en 1834 pol químicu alemán Justus Liebig.[3] etilo ye una contraición de la pallabra francesa éter (cualquier sustancia que s'evapora o sublima fácilmente a temperatura ambiente) y la pallabra griega ύλη ( hylé, sustancia).
El nome d'etanol foi acuñáu como resultáu d'una resolución que foi adoptáu na Conferencia Internacional sobre Nomenclatura Química que se celebró n'abril de 1892 en Xinebra, Suiza.
Pa más información, vease etanol (combustible)
L'etanol a temperatura y presión ambientes ye un llíquidu incoloro y volátil que ta presente en delles bébores lleldaes. Dende l'antigüedá llográbase l'etanol por fermentadura anaeróbico d'una disolución con conteníu n'azucres con lleldu y posterior destilación.
Dependiendo del xéneru de bébora alcohólico que lu contenga, l'etanol apaez acompañáu de distintes sustancies químiques que lu doten de color, sabor, y golor, ente otres carauterístiques.
Pa llograr etanol llibre d'agua aplícase la destilación azeotrópica nun amiestu con bencenu o ciclohexanu. D'estos amiestos destílase a temperatures más baxes l'azeótropu, formáu pol disolvente auxiliar col agua, ente que l'etanol quédase reteníu. Otru métodu de purificación bien usáu anguaño ye l'absorción física per aciu cribos moleculares. A escala de llaboratoriu tamién puen usase desecantes como'l magnesiu, que reacciona col agua formando hidróxenu y óxidu de magnesiu.
Amás d'usase con fines culinarios (bébora alcohólico), l'etanol úsase llargamente en munchos sectores industriales y nel sector farmacéuticu, como excipiente de dalgunes melecines y cosméticos (ye'l casu del alcohol antisépticu 70º GL y na ellaboración d'ambientadores y arumes).
Ye un bon disolvente, y pue usase como anticonxelante. Tamién ye un desinfestante. El so mayor potencial bactericida llógrase a una concentración d'aproximao'l 70 %.
La industria químico úsalu como compuestu de partida na síntesis de dellos productos, como'l acetatu d'etilo (un disolvente pa pegamentos, pintures, etc.), l'éter dietílico, etc.
Tamién s'aprovechen les sos propiedaes desinfestantes.
Emplégase como combustible industrial y domésticu. Esti amás contién compuestos como la pirovitos puramente a alcohol. Esta última aplicación estiéndese tamién cada vegada más n'otros países pa cumplir col protocolu de Kyoto. Estudios del Departamentu d'Enerxía d'Estaos Xuníos dicen que l'usu n'automóviles amenorga la producción de gases d'invernaderu nun 85 %.[ensin referencies]
El etanol actúa sobre los receptores GABA de tipu A (GABAa) como modulador alostérico positivu aumentando'l fluxu d'iones trasmembrana lo qu'induz a un estáu de inhibición neuroquímica (efeutu ralentizador). Produz efeutos similares a les benzodiazepines y los barbitúricos, qu'actúen sobre'l mesmu receptor anque en sitios distintos. Esta semeyanza inclúi'l potencial adictivu, que tamién ye similar.

El etanol puede afectar al sistema nerviosu central, provocando estaos d'euforia, desinhibición, mareos, somnolencia, tracamundiu, ilusiones (como ver doble o que tou mover de forma bonal). Coles mesmes, baxa los reflexos. Con concentraciones más altes ralentiza los movimientos, torga la coordinación correuta de los miembros, perda temporal de la visión, descargues eméticas, etc. En ciertos casos produz un medría na irritabilidá del suxetu intosicáu como tamién na agresividá; n'otra cierta cantidá d'individuos vese afeutada la zona que controla los impulsos, volviéndose impulsivamente desafranaos y frenéticos. Finalmente, conduz a la coma y puede provocar muerte.
La resistencia al alcohol nun paez aumentar nes persones adultes, de mayor pesu y de menor altor, ente que los neños son especialmente vulnerables. Comunicáronse casos de ñácaros que morrieron por intoxicación debida a la inhalación de vapores de etanol en habiéndo-yos aplicáu trapos trescalaos d'alcohol. La ingesta en neños puede conducir a un retardo mental agraváu o a un subdesarrollu físico y mental. Tamién se realizaron estudios que demuestren que si les madres inxeríen alcohol mientres l'embaranzu, los sos fíos podíen ser más propensos a tener el síndrome d'alcohólicu fetal.
Un métodu de determinación de la concentración averada de etanol nel sangre aprovecha'l fechu de que nos pulmones forma un equilibriu que rellaciona esta concentración cola concentración de vapor de etanol nel aire espirado. Esti aire faise pasar per un tubu onde se topa xel de siliciu trescaláu con un amiestu de dicromato y d'ácidu sulfúricu. El dicromato, de color coloráu anaranxáu, aferruña'l etanol a acetaldehído y ye amenorgáu, de la mesma, a cromu (III), de color verde. El llargor de la zona que camudó de color indica la cantidá de etanol presente nel aire si faise pasar un determináu volume pol tubu.