Infrastructure tools to support an effective radiation oncology learning health system


Hemija ili kemija (srednjovj. lat. chemia, chymia < grč. χημεία, χυμεία: miješanje metala), prirodna nauka koja se bavi proučavanjem građe, osobina i promena supstanci kao i zakona po kojima se te promene dešavaju.[1][2] Klasično se izdvajaju četiri ključna polja u hemiji, mada postoji daleko veći broj usko specijalizovanih grana: opšta hemija, neorganska hemija, organska hemija i biohemija. Hemija je jedna od elementarnih nauka, pored matematike bliska je i: fizici, biologiji, farmaciji, medicini. U mnogim poslovima kao i u svakodnevnom životu zastupljena je hemija.
Hemija zauzima centralno mesto među prirodnim naukama. Između ostalog, bavi se i molekulima, njihovom strukturom, osobinama i transformacijama, i principima na kojima se osobine molekula zasnivaju. Zbog ove svoje sveobuhvatnosti, hemija ima dosta zajedničkih tema sa drugim prirodnim naukama, kao što su fizika, geologija i astronomija, s jedne strane, i biologija, fiziologija i medicina, s druge.[3][4] Hemija je grana fizičkih nauka ali postoji određena razlika od fizike.[5] Etimologija pojma hemija nije u potpunosti razjašnjena, pa je u tom pogledu tema određenih neslaganja. Historija hemije se može pratiti i preko određenih faza u njenom razvoju, poput alhemije, koja se praktikovala hiljadama godina u mnogim dijelovima svijeta.
Etimologija
Pojam hemija potječe od riječi alhemija, ranijeg skupa aktivnosti koji su obuhvatali elemente iz moderne hemije, metalurgije, filozofije, astrologije, astronomije, misticizma i medicine. Ona se obično smatrala kao potraga za načinom pretvaranja olova ili nekog drugog uobičajenog materijala u zlato.[6] Alhemija se počela praktikovati oko 330. godine, uključivala je proučavanje sastava vode, njenog kretanja, rasta, pridruživanja i izlučivanja iz drugih supstanci, izvlačenja duhova iz tijela kao i njihovim spajanjem unutar tijela (Zosim iz Panopolisa).[7] Alhemičari su se u narodnom govoru zvali hemičari, a kasniji sufiks -ija je dodan kako bi se opisala vještina hemičara kao hemija.
Riječ alhemija je izvedena iz arapske riječi al-kimia (الکیمیاء). U korijenu, pojam je posuđen iz grčkog χημία ili χημεία.[8][9] Dalje, ovaj pojam je možda i egipatskog porijekla. Mnogi vjeruju da je al-kimia izvedena iz grčkog χημία, a koja se opet dobila preko riječi chemi ili kimi, što je drevno ime Egipta u egipatskom jeziku.[8] Po drugom mišljenju, al-kimia je možda izvedena iz χημεία, u značenju izliti (spojiti) zajedno.[10]
Definicija
Retrospektivno, definicija hemije se mijenjala kroz historiju, kako su nova otkrića i teorije dodavne nove funkcionalnosti u ovu nauku. Pojam hemija, po mišljenju poznatog hemičara Boyla 1661. koji je smatrao da je ona subjekat materijalnih principa mješanih (složenih) tijela.[11] Dvije godine kasnije, 1663. hemičar Christopher Glaser opisao je hemiju kao naučnu umjetnost, koja izučava rastvorena tijela te iz njih izvlači različite supstance od kojih su ona izgrađena, kao i način kako da ih ponovno spojiti i dovesti ih do savršenosti višeg nivoa.[12]
Definicija riječi hemija iz 1730. koju je koristio Georg Ernst Stahl značila je umjetnost razdvajanja miješanih, agregatnih i spojenih tijela u njihove sastojke; kao i sastavljanje takvih tijela iz tih sastojaka.[13] Jean-Baptiste Dumas je 1837. smatrao pojam hemije kao nauku koja izučava zakone i efekte molekularnih sila.[14] Ova definicija je kasnije evoluirala, pa se 1947. došlo do značenja nauke o supstancama: njihovoj strukturi, osobinama i reakcijama koje ih pretvaraju u druge supstance, a ovu karakterizaciju hemije prihvatio je i Linus Pauling.[15] U novije doba, 1998. profesor Raymond Chang proširio je tu definiciju na proučavanje materije i promjena koje se dešavaju s njom.[16]
Pregled
Atomska teorija je osnova kemije. Ta teorija kaže da se sve tvari sastoje od vrlo malih čestica po imenu atomi. Jedan od prvih zakona koji je doveo do utemeljenja kemije kao znanosti bio je Zakon očuvanja mase. Taj zakon kaže da tijekom kemijske reakcije nema primjetne promjene u količini tvari. (Moderna je fizika pokazala da se zapravo radi o očuvanju energije, te da su energija i masa povezane.)
Jednostavno rečeno, ako na početku imate 10,000 atoma i napravite mnogo kemijskih reakcija, na kraju ćete opet imati 10,000 atoma. Masa je ostala ista ako uračunamo energiju koja se pritom izgubila ili stekla. Kemija proučava odnose među atomima: ponekad među pojedinačnim atomima, ali češće kad su atomi vezani uz druge atome i čine ione i molekule. Atomi stupaju u odnos s drugim atomima (npr. logorska vatra je kombinacija atoma kiseonika
iz zraka s atomima ugljika i vodika iz drveta), a mogu imati odnos i sa svjetlom (fotografija nastaje zbog promjena koje svjetlo izaziva na kemikalijama filmske vrpce) i drugim zračenjima.
Neobično se brzo otkrilo da se atomi gotovo uvijek slažu u određenim omjerima: silicijski pijesak je struktura gdje omjer atoma silicija i atoma kisika iznosi 1:2. Danas znamo da taj zakon određenih proporcija ima iznimke (npr. integrirani strujni krugovi).
Drugo ključno otkriće: kad god se izvodi određena kemijska reakcija, količina stečene ili izgubljene energije uvijek je ista. To je dovelo do važnih pojmova kao što su ravnoteža, termodinamika i kinetika.
Fizikalna hemija zasniva se na modernoj fizici, jer je u načelu moguće opisati sve kemijske sustave koristeći teoriju kvantne mehanike. Ta je teorija matematički složena i kosi se sa zdravim razumom. Ipak, u praksi se samo najjednostavniji kemijski sustavi mogu istraživati isključivo kroz kvantnu mehaniku, te se za praktične svrhe moraju raditi aproksimacije. Zato u većem dijelu kemije nije potrebno detaljno znanje kvantne mehanike, jer se važne posljedice te teorije (prvenstveno orbitalna aproksimacija) mogu razumjeti i primijeniti na jednostavniji način.
Iako se kvantna mehanika često može zanemariti, njezin osnovni pojam - kvantizacija energije - mora se uzeti u obzir. Kemičari koriste kvantne efekte prilikom svih spektroskopskih tehnika (i raznih drugih stvari), iako mnogi kemičari nisu svjesni toga! Osim toga, često se i fizika može zanemariti, a konačni rezultat (npr. spektar NMR) svejedno može imati smisla.
Potpun fizikalni opis kemije mora također uzeti u obzir relativnost, koja je druga glavna teorija moderne fizike, također matematički složena. Srećom, efekti relativiteta važni su samo u izuzetno preciznim izračunima atomske strukture, koji se uglavnom tiču težih elemenata, dok je u praksi relativnost nevažna za gotovo čitavu kemiju.
Kemija se obično dijeli ovako: analitička hemija, koja određuje sastav i dijelove tvari; organska hemija, koja proučava ugljikove spojeve; anorganska hemija, koja istražuje šire elemente koje organska hemija ne naglašava; biohemija, proučavanje kemije u biološkom sustavu; i fizikalna hemija, koja je osnova svih drugih grana jer obuhvaća fizikalne osobine tvari i teorije za njihovo istraživanje.
Neke druge multidisciplinarne i specijalizirane grane: znanost materijala, hemija polimera, hemija životne sredine, farmacija.
Istorija hemije


Stare civilizacije, poput Egipćana,[17] Babilonaca i Indijaca[18] stekle su ogromno praktično znanje o vještinama metalurgije, izrade grnčarije i pravljenja boja, ali o tome nisu razvili sistematsku teoriju.
Osnovne hemijske hipoteze prvo su se pojavile u klasičnoj Grčkoj u vidu teorije "četiri elementa" što je konačno uobličio Aristotel navodeći da su vatra, zrak, zemlja i voda četiri temeljna elementa čijim je kombiniranjem izgrađeno sve ostalo. Grčki atomizam potječe iz 440tih p.n.e., nastao u djelima filozofa kao što su Demokrit i Epikur. Rimski filozof Lukrecije je 50 p.n.e. razvio ovu teoriju u svojoj knjizi De rerum natura ("O prirodi stvari").[19][20] Za razliku od modernog koncepta nauke, grčki atomizam je bio čisto filozofske prirode, sa vrlo slabim vezama sa iskustvenim posmatranjima i bez ikakvog osvrta na hemijske eksperimente.[21]
Vještina alhemije je najprije doživjela procvat u helenističkom svijetu, gdje su se miješale magija i okultizam u proučavanje prirodnih supstanci, s krajnjim ciljem pretvaranja elemenata u zlato i otkrivanje napitka vječnog života.[22] Alhemija je otkrivena i praktikovana širom arapskog svijeta nakon pojave islama,[23] a od tamo se prelila u srednjovjekovnu i renesansnu Evropu preko latinskih prevoda.[24]
Hemija kao nauka
Pod utjecajem novih iskustvenih metoda koje su predložili Francis Bacon i drugi, grupa hemičara na Univerzitetu u Oxfordu, Robert Boyle, Robert Hooke i John Mayow počeli su da iznova oblikuju stare alhemijske tradicije u naučnu disciplinu. Naročito se Boyle smatra za osnivača i "oca" hemije zbog svog najvažnije rada, teksta iz oblasti klasične hemije "Skeptični hemičar" (The Sceptical Chymist) gdje su navedene osnovne razlike između postavki alhemije i iskustvenih naučnih otkrića nove hemije.[25] On je, između ostalog, objavio i Boyleov zakon, čime je odbio klasične postavke "četiri elementa" i predložio mehanističke alternative atoma i hemijskih reakcija koje bi mogle biti subjekat strogih eksperimenata.[26]

Teoriju flogistona (supstance koja je u osnovi svakog sagorijevanja) predložio je Nijemac Georg Ernst Stahl početkom 18. vijeka a tu teoriju je tek krajem tog vijeka opovrgnuo francuski hemičar Antoine Lavoisier, "hemijski" pandan Newtonu u fizici; koji je učinio više od bilo koga drugog za osnivanje nove nauke na ispravnim teoretskim osnovama, tako što je rasvijetlio princip održanja mase i razvio novi sistem hemijske nomenklature, koji se i danas manje-više koristi.[28]
Međutim, prije ovog njegovog rada, postignuta su mnoga važna otkrića, naročito u vezi prirode zraka, za koji se ispostavilo da je sastavljen iz mnogih različitih gasova. Škotski hemičar Joseph Black (prvi eksperimentalni hemičar) i Holanđanin J. B. van Helmont otkrili su ugljik-dioksid, ili ono što je Black nazivao "fiksni zrak" 1754. godine; Henry Cavendish je otkrio vodik i rasvijetlio mnoge njegove osobine, dok su Joseph Priestley i, nezavisno od njega, Carl Wilhelm Scheele izdvojili čisti kisik.
Engleski naučnik John Dalton postavio je modernu teoriju atoma; po kojoj su sve supstance sastavljene iz nevidljivih atoma materije i da različiti atomi imaju različite atomske težine. Razvoj elektrohemijske teorije hemijskih kombinacija desio se početkom 19. vijeka naročito kao rezultat rada dvojice naučnika Jacob Berzeliusa i Humphryja Davyja, a zasnovanog na ranijim otkrićima elektrostatičkog stuba koji je napravio Alessandro Volta. Davy je otkrio devet novih elemenata uključujući alkalne metale izdvajajući ih iz njihovih oksida pomoću električne struje.[29]
Britanac William Prout prvi je predložio sortiranje svih hemijskih elemenata prema njihovim atomskim težinama, tako što je sve poznate atome izrazio omjerom njihove težine prema atomskoj težini vodika. Newlands je napravio prvobitni sistem elemenata, koji su kasnije razvili u moderni periodni sistem elemenata[30] Nijemac Lothar Meyer i Rus Dmitrij Ivanovič Mendeljejev tokom 1860tih.[31] Inertne gasove, kasnije nazvani plemeniti gasovi, otkrio je William Ramsay u saradnji sa Lordom Rayleighjem krajem 19. vijeka, pa su s tim otkrićem popunjene osnovne strukture tabele periodnog sistema.
Organsku hemiju razvio je Justus von Liebig i njegovi savremenici, nakon što je Friedrich Wöhler sintetizirao ureu kojim je zapravo potvrđeno da se živi organizmi, teoretski, mogu posmatrati i svesti pod hemijske zakone.[32] Druga važna otkrića 19. vijeka bila su, između ostalog, razumijevanje valencije veze (Edward Frankland 1852. godine) i primjena termodinamike u hemiji (J. W. Gibbs i Svante Arrhenius tokom 1870tih).
Hemijska struktura
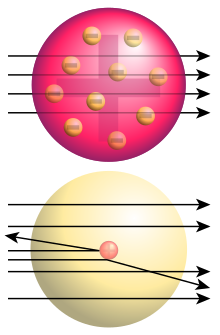
dolje: dobijeni rezultati: manji dio čestica je odbijen, dajući indiciju da postoji malehni, koncentrični naboj (atomsko jezgro).
Tek početkom 20. vijeka konačno su shvaćene teoretske osnove hemije nakon serije značajnih otkrića, koji su rezultat uspjelih pokusa u istraživanju prave prirode unutrašnje strukture atoma. Godine 1897. J. J. Thomson je na Univerzitetu Cambridge otkrio elektron a vrlo brzo njega je francuski naučnik Becquerel kao i bračni par Pierre i Marie Curie istraživali fenomen radioaktivnosti. U seriji pionirskih eksperimenata Ernest Rutherford je na Univerzitetu u Manchesteru otkrio unutrašnju strukturu atoma i postojanje protona, klasificirao je i objasnio različite vrste radioaktivnog zračenja i uspješno transmutirao prvi element bombardujući dušik alfa-česticama.
Njegov rad na atomskoj strukturi razvili su i poboljšali njegovi učenici, danski fizičar Niels Bohr i Englez Henry Moseley. Elektronsku teoriju hemijskih veza i molekulskih orbitala razvili su američki naučnici Linus Pauling i Gilbert N. Lewis.
Godinu 2011. Ujedinjeni narodi su proglasili Međunarodnom godinom hemije.[33] Godina je proglašena na inicijativu IUPAC-a (Međunarodne unije čiste i primijenjene hemije) te UN organizacije za nauku, obrazovanje i kulturu, a uključivao je hemijska društva, akademije i institucije u svijetu a zasnivala se na individualnim inicijativama za organiziranje lokalnih i regionalnih aktivnosti.
Podela
Analitička hemija

Analitička hemija je nauka koja se bavi proučavanjem hemijskih i fizičkih procesa na osnovu kojih se može odrediti kvalitativni i kvantitativni sastav ispitivane supstance. Zbog toga se ova nauka deli na dve oblasti: kvalitativnu i kvantitativnu analizu. Kvalitativna analiza po pravilu prethodi kvantitativnoj i njome se utvrđuje iz kojih se elemenata, jona, atomskih (funkcionalnih) grupa i molekula sastoji ispitivana supstanca. Kvantitativna analiza se zasniva na utvrđivanju ili količina ispitivanih supstanci ili odnosa u kome se date supstance nalaze. Metode kojima se pri tome analitička hemija koristi se mogu podeliti na hemijske, fizičke i fizičko-hemijske.
Neorganska hemija
Hemija je zapravo nauka koja proučava sastav i osobine supstanci, kao i pojave koje se dešavaju kada supstance reaguju jedna sa drugom. Neorganska hemija predstavlja veliki deo hemije jer ona proučava hemijska svojstva i reakcije svih hemijskih elemenata i njihovih jedinjenja kao i hemijske procese koji se zbivaju među njima. Izuzetak čine jedinjenja (četvorovalentnog) ugljenika koje izučava organska hemija.
Organska hemija
Organska hemija je, najopštije postavljeno, hemijska disciplina koja se bavi proučavanjem ugljenika i njegovih jedinjenja.[34] Nešto konkretnije, to je nauka koja proučava svojstva, strukturu i reaktivnost organskih jedinjenja, kao i načine na koji se ta saznanja mogu primeniti u sintezi željenih jedinjenja. I pored sugestivnog naziva, spektar struktura kojima se bavi organska hemija nipošto nije ograničen na supstance poreklom iz živog sveta; naprotiv, organska sinteza bavi se dobijanjem novih organskih jedinjenja iz najrazličitijih prekursora. Ipak, za sva jedinjenja kojima se bavi organska hemija zajedničko je da sadrže četvorovalentni ugljenik.
Početkom 19. veka iz biljaka su izolovane organske supstance koje su po svojim osobinama bile potpuno drugačije od svih do tada poznatih jedinjenja. Doktrina vitalizma, koju je zastupao veliki broj hemičara tadašnjice, tvrdila je da je osobenost svih takvih jedinjenja prisustvo „životne sile“ (lat. vis vitalis), bez čijeg učešća je ujedno i nemoguće sintetisati organsku materiju. Ovakav rigidan stav po kojem sinteza organskih struktura (koje su tada smatrane posebno složenima) može da se odigra samo u živim organizmima, a nikako u reakcionoj smeši, efektivno je zakočio dalji razvoj organske hemije. 1828. godine, međutim, nemački hemičar Fridrih Veler je sasvim slučajno, u pokušaju da dobije amonijum-cijanat iz cijanatne kiseline i amonijaka, dobio supstancu koju je uspešno identifikovao kao ureju. Ureja je danas poznata kao značajan finalni produkt metabolizma sisara, ali je i u Velerovo vreme bila klasifikovana kao organsko jedinjenje, jer je ranije bila izolovana iz urina. Velerovom sintezom srušen je postulat da je nemoguće dobiti organsko jedinjenje iz neorganskih prekursora. Ovo otkriće predstavljalo je prekretnicu u razvitku organske hemije koje je dovelo do njene velike ekspanzije.
Tokom protekla dva veka naučna osnova organske hemije znatno je proširena, zahvaljujući i razvoju drugih hemijskih disciplina. Ima velike implikacije u brojnim drugim poljima nauke i privrede — petrohemiji, farmaciji, industriji plastičnih masa, prehrambenoj industriji, industriji boja i lakova...
Glavni akcenat u organskoj hemiji danas je na organskoj i hiralnoj sintezi, zatim zelenoj hemiji, mikrotalasnoj hemiji i hemiji fulerena.
Fizička hemija
Fizička hemija je nastala kombinovanjem znanja iz fizike, hemije, termodinamike i kvantne mehanike da bi se opažene makroskopske pojave opisale na atomskom i molekulskom nivou, dakle, fizička hemija se bavi vezom između mikroskopskih i makroskopskih osobina materije. Na primer, veličina molekula u tečnosti može da se odredi na osnovu merenja njenog indeksa prelamanja i gustine, ili na osnovu toplotnog kapaciteta i površinskog napona.
Biohemija
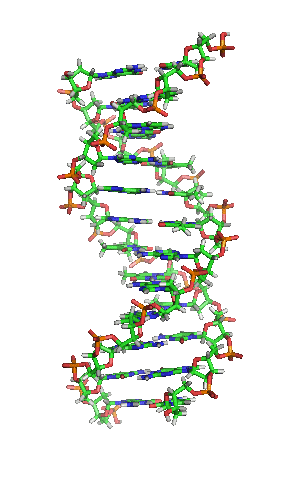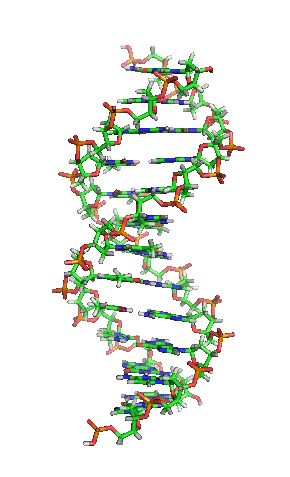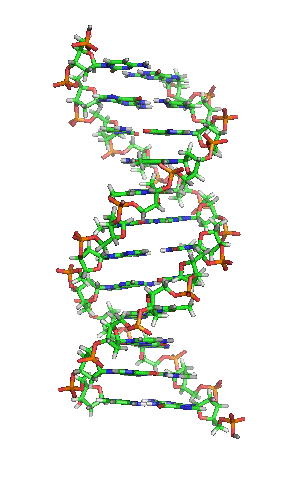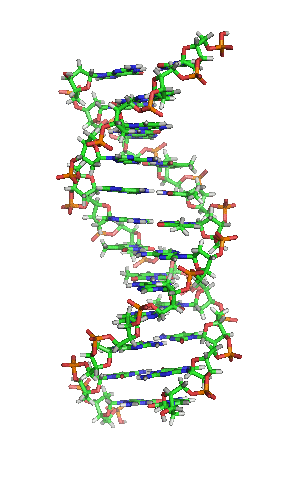
Biohemija je most između biologije i hemije koji proučava kako kompleksne hemijske reakcije stvaraju život. Biohemija je hibridni deo hemije koji konkretno proučava hemijske procese u živim organizmima. Ovaj članak diskutuje samo kopnenu biohemiju, koja počiva na ugljeniku i vodi. Kako svi oblici života koje danas imamo na planeti imaju zajedničko poreklo, prema tome imaju i slične biohemije, kao što su genetički kod i stereohemija mnogih biomolekula. Nepoznato je da li su naizmenične biohemije uopšte i moguće.
Biohemija proučava strukturu i fuknciju celularnih komponenti, kao što su proteini, ugljeni hidrati, lipidi, nukleinske kiseline i ostali biomolekuli. Iako postoji ogroman broj različitih biomolekula, oni se često sastoje od istih jedinica koje se ponavljaju monomera, ali koji se ponavljaju u različitim sekvencima. Nedavno, biohemija je počela da se fokusira na proučavanje reakcija u kojima su katalizatori enzimi, i na proučavanje osobina proteina.
Biohemija metabolizma ćelije i biohemija endokrinog sistema su dva domena koja su intenzivno studirana. Druge oblasti koje spadaju pod pojam biohemije su genetički kod (DNK, RNK), sinteza proteina, transport kroz ćelijsku membranu i transdukcija signala.
Teorijska hemija
Teorijska hemija je podoblast hemije koja koristi znanja iz fizike da se objasne ili predvide hemijski fenomeni. U prethodnim godinama činila ju je samo kvantna hemija, tj. primena kvantne mehanike da bi se rešili problemi u hemiji. Gruba potpodela teorijske hemije su elektronske strukture, dinamika i statistička mehanika. U procesu rešavanja problema, sve tri potgrane mogu biti uključene u različitom stepenu. Od kraja Drugog svetskog rata, razvoj računara je omogućio sistematski razvoj računske hemije, veštine ravijanja i primene računarskih programa za rešavanje hemijskih problema. Teorijska hemija se u velikoj meri preklapa sa (teorijskom ili eksperimentalnom) fizikom kondenzovane materije i molekularnom fizikom.
Principi moderne hemije

Danas prihvaćeni model atomske strukture je kvantnomehanički model.[36] Tradicionalna hemija počinje proučavanjem elementarnih čestica, atoma, molekula,[37] hemijskih jedinjenja, metala, kristala i drugih agregata materije. Ova materija se može proučavati u tri (uobičajena) agregatna stanja: čvrstom, tečnom ili gasovitom stanju, bilo u pojedinačnom ili njihovoj kombinaciji. Međudjelovanja, reakcije i transformacije koje se proučavaju u hemiji obično su rezultat interakcije između atoma, koji dovode do reorganiziranja hemijskih veza koje drže atome povezane jedne s drugima. Takva ponašanja se ispituju u hemijskim laboratorijama. Prema stereotipskim mišljenjima, u hemijskim laboratorijama se koriste razni oblici laboratorijskog posuđa. Međutim, posuđe nije osnovno u hemijskim naukama, a veliki broj eksperimenata u hemiji, kako primijenjenoj tako i u industrijskoj, izvodi se bez njega.
Hemijska reakcija je transformacija nekih supstanci u jednu ili više drugačijih supstanci.[38] Osnova za takve hemijske transformacije je reorganiziranje elektrona u hemijskim vezama između atoma. One se simbolički mogu predstaviti pomoću hemijskih jednačina, koje obično uključuju atome kao subjekte. Broj atoma na lijevoj i na desnoj strani jednačine moraju biti jednaki. Samo u posebnim slučajevima kada broj atoma na suprotnim stranama jednačine nije isti, takva transformacija se naziva nuklearna reakcija ili radioaktivni raspad. Vrste hemijskih reakcija u koje mogu stupati supstance i promjene energije povezane sa njima obuhvaćene su određenim osnovnim pravilima, poznatim kao hemijski zakoni.
Razmatranja o energiji i entropiji su nezamjenjivo važna u gotovo svim oblastima hemije. Hemijske supstance se dijele po njihovoj strukturi, fazama, kao i po hemijskom sastavu. One se mogu analizirati koristeći alate hemijske analize kao što su spektroskopija i hromatografija. Naučnici koji se bave hemijskim istraživanjima nazivaju se hemičarima.[39] Većina modernih hemičara se specijalizira u jednoj ili više podoblasti hemije. Za detaljno izučavanje hemije postoje brojni koncepti od nezamjenjivog značaja, a neki od njih su:[40]
Materija

U hemiji, materija je definirana kao sve ono što ima masu u mirovanju i zapreminu (zauzima prostor) i sačinjeno je od čestica. Čestice koje sačinjavaju materiju također imaju vlastitu masu u mirovanju, ali je nemaju sve čestice, kao što su naprimjer fotoni. Materija može biti čista supstanca ili smjesa dvije ili više supstanci.[41]
Atom
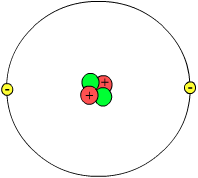
Atom (grčki άτομον (atomon) - nedeljiv) je najmanji delić supstance, tj. hemijskog elementa koji ispoljava sve osobine tog hemijskog elementa. Atom se sastoji iz jezgra i elektronskog omotača.[41]
Jezgro čine:
- Protoni, sa pozitivnim naelektrisanjem i jediničnom masom i
- Neutroni, koji imaju jediničnu masu ali nisu naelektrisani.
Omotač čine:
- Elektroni, koji imaju negativno naelektrisanje i zanemarljivo malu masu.
Hemijske osobine atoma određuje broj protona u njemu (redni broj) i taj broj je jedinstven za svaki element, a masu broj protona i broj neutrona. Atom kao celina je neutralan jer sadrži isti broj elektrona i protona. Atom postaje naeletrisan tako što primi ili otpusti jedan ili više elektrona i postaje jon.
Hemijske osobine atoma ne zavise od broja neutrona, pa postoje atomi istog elementa sa različitim brojem neutrona - izotopi.
Molekul


Molekul je najmanja jedinica hemijskog jedinjenja koja zadržava hemijski sastav i svojstva. Molekul se sastoji iz više atoma, istog hemijskog elementa kao kod kiseonika, (O2), ili iz različitih elemenata kao kod vode (H2O).
Molekuli su suviše mali da bi se videli golim okom. Dimenzija su od 0,1 do 100 nanometara (0,0000000001 do 0,0000001 metara) mada ima i izuzetaka. Recimo makromolekul DNK kad bi se izvadio iz jedra ćelije i razmotao dostigao bi dužinu jednog do dva metra.[42] Međutim i tada bi bio nevidljiv jer bi njegovo 'vlakno' bilo prečnika svega 0,000000005 m. Zato se za određivanje veličine i oblika molekula koriste posebne metode fizičke hemije a naročito instrumentalne metode.
Odnos elemenata koji grade jedinjenje, izražava se empirijskom formulom. Na primer, vodu grade vodonik i kiseonik u odnosu 2:1, H2O, a etil alkohol, (etanol) ugljenik, vodonik i kiseonik u odnosu 2:6:1, C2H6O. Ovaj odnos ne mora uvek da određuje jedinstveni molekul - dimetil etar ima isti odnos kao etanol, na primer. Molekuli koji se sastoje od istih atoma, ali u različitom rasporedu se zovu izomeri.
Hemijska ili molekulska formula određuje tačnije redosled atoma koji grade molekul, pa je formula etanola CH3CH2OH a dimetiletra CH3OCH3. Za predstavljanje složenijih molekula gde atomi mogu biti različito raspoređeni u prostoru koriste se strukturne formule. Molekulska masa je zbir masa atoma koji čine molekul, i poput atomske, izražava se u atomskim jedinicama mase (atomska jedinica mase = 1/12 mase izotopa 12C). Dugo se mislilo da su dužine hemijski veza i njihovi uglovi u molekulu konstantni. Međutim, modernim strukturnim metodama nađeno je da se geometrija hemijske veze neznatno menja, naročito kod složenijih molekula.
Mol
Mol (simbol: mol) je jedna od sedam SI osnovnih jedinica koja meri količinu supstance sistema. Jedan mol je količina supstance koja sadrži toliko čestica koliko ima atoma u tačno 0,012 kilograma ugljenika izotopa C12. Ova količina je poznata kao Avogadrov broj i približno iznosi 6,0221415 × 10²³.[43][44]
Zbog veze jedinice atomske mase sa Avogadrovim brojem, praktični način iskazivanja ovoga za atome ili molekule je: Količina supstance koja sadrži isti broj grama kao i broj atomske mase supstance. Pošto gvožđe, na primer, ima atomsku masu od 55,845, u jednom molu gvožđa ima 55,845 grama (0,055845 kilograma).
Kada se mol koristi da bi se odredila količina supstance, potrebno je navesti i o kojoj vrsti čestica se radi, jer to mogu biti atomi, molekuli, joni... Na primer, 18 grama vode sadrži 1 mol molekula, 2 mola atoma vodonika, 1 mol atoma kiseonika ili ukupno 3 mola atoma.
Element

Hemijski element se karakteriše određenim brojem protona u jezgru njegovih atoma. Ovaj broj se naziva atomski broj elementa. Na primer, svi atomi sa 6 protona u svom jezgru su atomi hemijskog elementa ugljenika, a svi atomi sa 92 protona su atomi uranijuma. Izotopi nekog hemijskog elementa mogu imati različiti broj neutrona u svom jezgru, dok im je broj protona isti. Na primer, običan vodonik ima samo jedan proton u jegru, a njegovi izotopi deuterijum i tricijum imaju po jedan proton i po jedan, odnosno dva neutrona u svom jezgru.[45]
Najpogodniji način za prikaz hemijskih elemenata je periodni sistem elemenata, u kom su elementi grupisani po svojim atomskim brojevima. Zahvaljujući njenom uređenju, grupe (vertikalne kolone) i periode (horizontalni redovi) elemenata u tabeli dele zajedničke hemijske osobine, ili prate određen trend u karakteristikama kao što su atomski radijus, elektronegativnost, itd.[46]
Jedinjenje

Hemijsko jedinjenje je čista supstanca koja se sastoji iz dva ili više elemenata.[47] Atomi koji sačinjavaju jedinjenje su međusobno vezani hemijskim vezama i čine molekul (ili kristalnu rešetku). Sastav hemijskih jedinjenja je stalan bez obzira na način njihovog postanka (to znači da je odnos atoma koji su povezani hemijskim vezama uvek isti). Tradicionalno se hemijska jedinjenja dele na organska i neorganska. Osim ovih, postoje i razne potpodele (na kiseline, baze, soli, okside itd.)
Međunarodna unija za čistu i primijenjenu hemiju (IUPAC) je postavila sistem standardne nomenklature za sve spojeve. Organski spojevi dobijaju ime u skladu sa sistemom organske nomenklature.[48] Neorganski spojevi dobijaju ime u skladu sa neorganskom nomenklaturom.[49] Osim toga Servis hemijskih sažetaka (Chemical Abstracts Service) preporučuje metod indeksiranja hemijskih supstanci. Po toj shemi, svaka hemijska supstanca se može jedinstveno identificirati pomoću broja poznatog kao CAS registarski broj.
Smeša

  | |
  | |
  | |
| Primjeri čistih hemijskih supstanci. S lijeva na desno: elementi kalaj (Sn) i sumpor (S), dijamant (alotrop ugljika), saharoza (čisti šećer) i natrijum-hlorid (so) i natrijum-hidrogenkarbonat (soda bikarbona), koje su ionski spojevi. |
Smeše su skupovi dve ili više različitih supstanci, za razliku od čistih (prostih) supstanci koje sačinjava samo jedan element ili jedno jedinjenje. Osobine smeša su aditivne, odnosno, ona zadržava osobine svih supstanci koje je čine.[50] Tako će smeša gvožđa i sumpora imati osobine i jednog i drugog elementa (gvožđe će i dalje imati magnetna svojstva, a sumpor žutu boju).[51] Smeše možemo podeliti na homogene i heterogene. One su obično heterogene, što znači da se jasno mogu uočiti razlike između supstanci koje ih čine. Međutim, dešava se da su sastojci neke smeše dovoljno mali da se ne mogu videti golim okom, pa takve smeše izgledaju homogeno. Takav je slučaj sa krvlju. Pod mikroskopom se vidi da krv sačinjava bezbojna tečnost sa suspendovanim česticama. Homogena je ona supstanca kod koje jedan deo ima potpuno isti sastav i osobine kao svaki drugi deo. Primeri za prave homogene smeše (jer se heterogenost ne može dokazati) su neki vodeni rastvori (šećera, soli itd.). Oslobađanje toplote, zračenja svetlosti ili stvaranje struje su pojave koje obično prate neku hemijsku reakciju. Ukoliko ne dođe do ovih pojava prilikom mešanja supstanci, pretpostavlja se da se nije desila hemijska reakcija, već da se napravila smeša. Sastojci u smeši se razdvajaju korišćenjem fizičkih promena supstanci. Pri tome se mogu koristiti različita fizička svojstva, kao što su magnetizam, specifična težina, (ne)rastvorljivost u odgovarajućim rastvaračima, tačka topljenja, kao i metode: destilacija, likvacija, difuzija, elutracija, flotacija.
Supstanca
Supstanca je oblik postojanja materije koji je dostupan ljudskim čulima. Karakteriše je masa mirovanja. Sastoji se od veoma sitnih čestica - atoma. Danas je poznato više od 40 milona različitih supstanci, od kojih su neke supstance pronađene u prirodi, dok se druge proizvode veštačkim putem.[52] Bez obzira na koji od ta dva načina pronađene, veliki broj njih, oko 100 hiljada ima praktičnu primenu.[53]
Svaka supstanca ima karakteristična svojstva po kojima se manje-više razlikuje od drugih supstanci, na primer: boju, miris, gustinu, temperaturu topljenja, temperaturu ključanja. Navedena i slična svojstva supstanci, koja se određuju pomoću naših čula ili instrumenata, nazivaju se fizička svojstva. Hemijska svojstva supstanci ispoljavaju se pri njihovim reakcijama sa drugim supstancama.
Hemijske veze
Hemijska veza je privlačna sila između dva atoma nastala interakcijom njihovih perifernih (valentnih) elektrona. Sila je mnogo jača od energije toplotnog kretanja tako da su atomi trajno vezani obrazujući stabilnu grupu - molekul. Elektroni su istog naelektrisanja pa bi trebalo da se odbijaju, međutim, u elektronskim orbitalama sparivanje njihovih spinova stabilizuje elektronske parove i ukupan efekat je obrazovanje stabilne veze. Dva osnovna tipa hemijske veze su jonska i kovalenta, ali se u prirodi sreću i 'mešane' veze, odnosno one koje imaju delimično jonski i delimično kovalentni karakter. U prilog tome ide i to što kovalentna veza može biti polarna i nepolarna. Poseban tip veze je metalna veza koja se stvara između atoma metala.
Joni

Jon je naelektrisana čestica (atom ili molekul) koja primila ili izgubila jedan ili više elektrona. Pozitivno naelektrisani katjoni (na primer natrijumov katjon Na+) i negativno naelektrisani anjoni (na primer hlorov anjon Cl−) mogu da obrazuju kristalnu rešetku neutralne soli (na primer natrijum hlorid ili kuhinjska so NaCl). Primeri višeatomskih jona koji se ne raspadaju tokom kiselinsko-baznih reakcija su hidroksidi (OH−) i fosfati (PO43−).
Jonizovani gasovi se često nazivaju plazma.
Hemijska reakcija

Hemijske reakcije predstavljaju trajne promene u strukturi polaznih supstanci (reaktanata ili reagujućih supstanci) i nastajanje novih supstanci (proizvoda) koje se po sastavu i svojstvima razlikuju od polaznih supstanci.
Hemijske reakcije se grubo mogu podeliti na:
- Oksido-redukcione reakcije;
- Komleksne reakcije;
- Hemijske reakcije pri kojima dolazi do disocijacije i asocijacije molekula, atoma i jona.
Hemijske reakcije odigravaju se sa promenom supstanci i sa određenim toplotnim efektom, pri čemu se oslobađa energija ili troši (vezuje ili otpušta). Ukoliko se prilikom reakcije troši ili oslobađa toplota onda se govori o termohemijskim reakcijama. Količina toplote koja se u toku hemijske reakcije oslobađa ili vezuje naziva se toplota reakcije.
Hemijske reakcije koje se odigravaju oslobađanjem toplote nazivaju se egzotermne reakcije. Hemijske reakcije koje se odigravaju sa vezivanjem toplote nazivaju se endotermne reakcije. Ako je hemijska reakcija u jednom smeru endotermna u drugom je egzotermna i obrnuto.
Energija
Neku hemijsku reakciju uvek prati povećanje ili gubitak energije supstanci koje učestvuju u reakciji. Deo energije se razmenjuje između okoline i reaktanata u obliku toplote ili svetlosti, tako da produkti reakcije mogu imati više ili manje energije od reaktanata. Za reakciju se kaže da je egzotermna ako je ukupna količina energije proizvoda reakcije niža od početne energije reaktanata, dok je kod endotermnih reakcija situacija obrnuta.
Hemijske reakcije nisu moguće sve dok energija reaktanata ne pređe energetsku barijeru koja se naziva energija aktivacije. Brzina hemijske reakcije (na nekoj temperaturi T) je povezana sa energijom aktivacije E preko Bolcmanovog faktora - što je verovatnoća da molekul ima energiju veću ili jednaku E na datoj temperaturi T. Ova eksponencijalna zavisnost brzine reakcije od temperature naziva se Arenijusova jednačina. Energija aktivacije potrebna za izvođenje hemijske reakcije može biti u obliku toplote, svetlosti, elektriciteta ili mehaničke sile u obliku ultrazvuka.[54]
Sa ovim je povezan koncept slobodne energije, koja uključuje i pojam entropije, a koje je vrlo korisno sredstvo za predviđanje izvodljivosti reakcije i određivanja stanja ravnoteže hemijske reakcije. Reakcija je izvodljiva samo ako je ukupna promena Gibsove slobodne entalpije negativna ; ako je jednaka nuli za hemijsku reakciju se kaže da je u ravnoteži.
Postoje samo ograničena moguća stanja energije elektrona, atoma i molekula. Ona su određena pravilima kvantne mehanike, koja zahteva kvantovanje energije. Za atome/molekule na višem energetskom stanju se kaže da su pobuđeni. Ti atomi/molekuli u pobuđenom stanju su često reaktivniji, što je preduslov za hemijske reakcije.
Agregatno stanje neke supstance je uvek određeno njenom energijom i energijom njene okoline. Kada su međumolekulske sile u supstanci takve da energija okruženja nije dovoljna da ih nadjača, supstanca se nalazi u uređenijim stanjima kao što su tečnosti i čvrsta tela, kao što je slučaj sa vodom (H2O), koja je tečnost na sobnoj temperaturi, jer su njeni molekuli povezani vodoničnim vezama.[55] Sa druge strane vodonik sulfid (H2S) je gas na sobnoj temperaturi i normalnom pritisku, jer su njegovi molekuli povezani slabijom dipol-dipol interakcijom.
Prelazak energije sa jedne supstance na drugu zavisi od veličine energetskog kvanta koji emituju supstance. Ipak, toplotna energija se lako prenosi sa skoro svake supstance na drugu jer su vibracioni i rotacioni energetski nivoi supstance smešteni vrlo blizu. Pošto elektronski energetski nivoi nisu blizu jedan drugog, ultraljubičasto elektromagnetno zračenje se ne prenosi istom lakoćom, a slično je i sa električnom energijom.
Postojanje karakterističnih linija energetskih prelaza različitih supstanci je korisno za njihovu identifikaciju analizom spektralnih linija različitih vrsta spektara, koja se često koristi u hemijskoj spektroskopiji, kao na primer u infracrvenoj ili mikrotalasnoj spektroskopiji, nuklearnoj magnetnoj rezonanciji, rezonanciji elektronskog spina, itd. Ovo se koristi za identifikaciju sastava udaljenih objekata, kao što su zvezde ili udaljene galaksije, analizom njenog spektra.
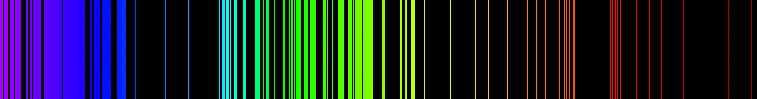
Termin hemijska energija se često koristi da se nagovesti potencijal supstance da izvrši tranformaciju putem hemijske rekacije odnosno sposobnost da preobrazi druge supstance.
Agregatno stanje

Pored specifičnih hemijskih osobina koji svrstavaju po različitim hemijskim klasifikacijama, hemikalije mogu postojati u nekoliko agregatnih stanja. U večini slučajeva, hemijske klasifikacije su nezavisne od ovih klasifikacija po stanju, međutim, određene egzotične faze nisu kompatibilne sa određenim hemijskim osobinama. Agregatno stanje je skup stanja hemijskog sistema u kojem on ima slične strukturne osobine, pod određenim uslovima okoline, od kojih su dva najznačajnija: pritisak i temperatura.
Fizičke osobine, poput gustoće i indeksa prelamanja teže da se kreću unutar vrijednosti karakterističnih za određeno agregatno stanje. Stanje materije se definira kao fazni prijelaz, u kojem, kada se energija dovede ili odvede iz sistema, prelazi u "preorganiziranje" strukture sistema, umjesto promjene općenitih uslova. Ponekad distikcija između faza može biti kontinuirana umjesto da ima jasnu granicu, u tom slučaju za materiju se kaže da je u superkritičnom stanju. Kada se tri stanja nalaze istovremeno pod određenim okolnostima, takvi uslovi se nazivaju trojna tačka, a pošto je ona invarijanta, uobičajeno se ona definira kao skup određenih uslova.
Najpoznatiji primjeri agregatnih stanja su čvrsta tijela, tekućine i gasovi. Mnoge supstance mogu postojati u oblika u čvrstoj fazi. Naprimjer, postoje tri faze čvrstog željeza (alfa, gama i delta) koje variraju u odnosu na temperaturu i pritisak. Osnovna razlika između čvrstih faza je kristalna struktura, ili aranžiranje atoma. Druga faza koja se obično javlja u studijama hemije je vodena odnosno tečna faza, koja je stanje supstance rastvorene u vodenom rastvoru (tj. u vodi).
Nešto manje uobičajene faze su stanje plazme, Bose-Einsteinovog kondenzata i fermionskog kondenzata, te paramagnetske i feromagnetske faze magnetičnih materijala. Iako se većina uobičajenih stanja odnosi u trodimenzionalne sisteme, tako je moguće definirati i analoge u dvodimenzionalnim sistemima, koje imaju posebnu pažnju zbog njihove relevatnosti u biološkim sistemima.
Poznati hemičari
- Marie Curie
- Pierre Curie
- John Dalton
- Jöns Jakob Berzelius
- Dmitrij Ivanovič Mendeljejev
- Antoine Laurent de Lavoisier
- Sir Ernest Rutherford
- Louis Pasteur
- Sir Humphry Davy
- Fritz Haber
- Robert Boyle
- Michael Faraday
- Linus Pauling
- Vladimir Prelog
- Leopold Ružička
- Eduard Buchner
- Mikhail Lomonosov
- Axel Fredrik Cronstedt
- Fritz Strassmann
- Sima Lozanić
Povezano
Reference
- ↑ „What is Chemistry?”. Chemweb.ucc.ie. Arhivirano iz originala na datum 2018-10-03. Pristupljeno 12.6.2011.
- ↑ Hemija. (n.d.). Merriam-Websterov medicinski rječnik, Pristupljeno 19. augusta 2007.
- ↑ Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. Chemistry: The Central Science. Prentice Hall; 8. izd. (1999). ISBN 0-13-010310-1. str 3–4.
- ↑ Carsten Reinhardt. Chemical Sciences in the 20th Century: Bridging Boundaries. Wiley-VCH, 2001. ISBN 3-527-30271-9. str 1–2.
- ↑ DOI:10.1007/BF01801556
This citation will be automatically completed in the next few minutes. You can jump the queue or - ↑ „History of Alchemy”. Alchemy Lab. Pristupljeno 12.6.2011.
- ↑ Strathern, P. (2000). Mendeleyev's Dream – the Quest for the Elements. New York: Berkley Books, ISBN 978-0-312-26204-4
- ↑ 8,0 8,1 Pojam "alhemija", u: The Oxford English Dictionary, J. A. Simpson, E. S. C. Weiner, vol. 1, 2. izd., 1989, ISBN 0-19-861213-3.
- ↑ "Arabic alchemy", Georges C. Anawati, str. 853–885 u: Encyclopedia of the history of Arabic science, ur. Roshdi Rashed i Régis Morelon, London: Routledge, 1996, vol. 3, ISBN 0-415-12412-3.
- ↑ Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. ISBN 0-486-21873-2
- ↑ Boyle, Robert (1661). The Sceptical Chymist. New York: Dover Publications, Inc. (reprint). ISBN 0-486-42825-7.
- ↑ Glaser, Christopher (1663). Traite de la chymie. Pariz. citirano u: Kim, Mi Gyung (2003). Affinity, That Elusive Dream - A Genealogy of the Chemical Revolution. The MIT Press. ISBN 0-262-11273-6.
- ↑ Stahl, George, E. (1730). Philosophical Principles of Universal Chemistry. London.
- ↑ Dumas, J. B. (1837). Affinite (predavanja), vii, str 4. "Statique chimique", Pariz: Académie des Sciences
- ↑ Pauling, Linus (1947). General Chemistry. Dover Publications, Inc.. ISBN 0-486-65622-5.
- ↑ Chang, Raymond (1998). Chemistry, 6. izd.. New York: McGraw Hill. ISBN 0-07-115221-0.
- ↑ First chemists, 13. februar 1999, New Scientist
- ↑ Ruth, Barnes. Textiles in Indian Ocean Societies. Routledge. str. 1.
- ↑ Lucretius. „de Rerum Natura (On the Nature of Things)”. The Internet Classics Archive. Massachusetts Institute of Technology. Pristupljeno 9.1.2007.
- ↑ Simpson, David (29.6.2005). „Lucretius (c. 99 - c. 55 BCE)”. The Internet History of Philosophy. Pristupljeno 9.1.2007.
- ↑ Strodach, George K. (2012). The Art of Happiness. New York: Penguin Classics. str. 7–8. ISBN 0-14-310721-6.
- ↑ „International Year of Chemistry - The History of Chemistry”. G.I.T. Laboratory Journal Europe. 25.2.2011. Arhivirano iz originala na datum 2013-06-15. Pristupljeno 12.3.2013.
- ↑ Morris Kline (1985) Mathematics for the nonmathematician. Courier Dover Publications. p. 284. ISBN 0-486-24823-2
- ↑ „Ancients & Alchemists - Time line of achievement”. Chemical Heritage Society. Arhivirano iz originala na datum 2010-06-20. Pristupljeno 23.3.2014.
- ↑ Harry Sootin (2011), Robert Boyle, Founder of Modern Chemistry, Literary Licensing, LLC, ISBN 978-1-258-11361-2
- ↑ „History - Robert Boyle (1627–1691)”. BBC. Pristupljeno 12.6.2011.
- ↑ Jennifer Sloan; Eagle, Cassandra T. (1998). „Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry” (PDF). The Chemical Educator 3 (5): 1–18. DOI:10.1007/s00897980249a. ISSN 1430-4171. Pristupljeno 2007-12-24.
- ↑ Mi Gyung Kim (2003). Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution. MIT Press. str. 440. ISBN 0-262-11273-6.
- ↑ Humphry, Davy (1808). „On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases”. Philosophical Transactions of the Royal Society (Royal Society of London.) 98 (0): 1–45. DOI:10.1098/rstl.1808.0001.
- ↑ Winter, Mark. „WebElements: the periodic table on the web”. The University of Sheffield. Arhivirano iz originala na datum 2014-01-04. Pristupljeno 27.1.2014.
- ↑ Timeline of Element Discovery - About.com
- ↑ Ihde, Aaron John (1984). The Development of Modern Chemistry. Courier Dover Publications. str. 164. ISBN 0-486-64235-6.
- ↑ „Chemistry”. Chemistry2011.org. Pristupljeno 10.3.2012.[mrtav link]
- ↑ K. Peter C. Vollhardt, Neil E. Schore: Organska hemija — struktura i funkcija, 4. izdanje, Data Status, Beograd, 2004.
- ↑ Edwards K.J., Brown D.G., Spink, N., Skelly J.V., Neidle S. (1992). „Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2. An examination of propeller twist and minor-groove water structure at 2.2 A resolution”. J.Mol.Biol. 226: 1161-1173. PMID 1518049.
- ↑ „chemical bonding”. Britannica. Encyclopædia Britannica. Pristupljeno 1.11.2012.
- ↑ Matter: Atoms from Democritus to Dalton autora: Anthony Carpi, prof.dr.
- ↑ Zlatna knjiga IUPAC-a definicija
- ↑ „California Occupational Guide Number 22: Chemists”. Calmis.ca.gov. 29.10.1999. Arhivirano iz originala na datum 2011-06-10. Pristupljeno 12.6.2011.
- ↑ „General Chemistry Online - Companion Notes: Matter”. Antoine.frostburg.edu. Pristupljeno 12.6.2011.
- ↑ 41,0 41,1 Armstrong, James (2012). General, Organic, and Biochemistry: An Applied Approach. Brooks/Cole. str. 48. ISBN 978-0-534-49349-3.
- ↑ Length of a Human DNA Molecule, Pristupljeno 29. 4. 2013.
- ↑ „Official SI Unit definitions”. Bipm.org. Pristupljeno 12.6.2011.
- ↑ Atkins & de Paula 2009: str. 9
- ↑ Housecroft & Sharpe 2008: str. 2
- ↑ Burrows 2009: str. 110
- ↑ Burrows 2009: str. 12
- ↑ „IUPAC Nomenclature of Organic Chemistry”. Acdlabs.com. Pristupljeno 12.6.2011.
- ↑ IUPAC Provisional Recommendations for the Nomenclature of Inorganic Chemistry (2004)[mrtav link]
- ↑ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (4. izd.). Upper Saddle River, New Jersey: Pearson Prentice Hall. str. 37.
- ↑ M. M. Avedesian, Hugh Baker. Magnesium and Magnesium Alloys. ASM International. str. 59.
- ↑ PubChem, Pristupljeno 29. 4. 2013.
- ↑ „Emerald | Management of Environmental Quality: An International Journal | A Swedish overview of selecting hazardous substances as pollution indicators in wastewater”. Emeraldinsight.com. DOI:10.1108/14777830410523116. Pristupljeno 24. 6. 2010.[mrtav link]
- ↑ Reilly, Michael. (2007).
- Mechanical force induces chemical reaction, NewScientist.com news service, Reilly
- ↑ Changing States of Matter - Chemforkids.com
Literatura
- Atkins, Peter; de Paula, Julio (2009) [1992]. Elements of Physical Chemistry (5th izd.). New York: Oxford University Press. ISBN 978-0-19-922672-6.
- Burrows, Andrew; Holman, John; Parsons, Andrew; Pilling, Gwen; Price, Gareth (2009). Chemistry3. Italy: Oxford University Press. ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Inorganic Chemistry (3rd izd.). Harlow, Essex: Pearson Education. ISBN 978-0-13-175553-6.
- Atkins, P.W. Galileo's Finger (Oxford University Press) ISBN 0-19-860941-8
- Atkins, P.W. Atkins' Molecules (Cambridge University Press) ISBN 0-521-82397-8
- Kean, Sam. The Disappearing Spoon - and other true tales from the Periodic Table (Black Swan) London, 2010 ISBN 978-0-552-77750-6
- Levi, Primo The Periodic Table (Penguin Books) [1975] translated from the Italian by Raymond Rosenthal (1984) ISBN 978-0-14-139944-7
- Stwertka, A. A Guide to the Elements (Oxford University Press) ISBN 0-19-515027-9
- „Dictionary of the History of Ideas”. Arhivirano iz originala na datum 2008-03-10. Pristupljeno 2015-04-21.
- Atkins, P.W., Overton, T., Rourke, J., Weller, M. and Armstrong, F. Shriver and Atkins inorganic chemistry (4th edition) 2006 (Oxford University Press) ISBN 0-19-926463-5
- Chang, Raymond. Chemistry 6th ed. Boston: James M. Smith, 1998. ISBN 0-07-115221-0.
- Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- Donald Voet, Judith G. Voet (2005). Biochemistry (3 izd.). Wiley. ISBN 978-0-471-19350-0.
- Atkins, P.W. Physical Chemistry (Oxford University Press) ISBN 0-19-879285-9
- Atkins, P.W. et al. Molecular Quantum Mechanics (Oxford University Press)
- McWeeny, R. Coulson's Valence (Oxford Science Publications) ISBN 0-19-855144-4
- Pauling, L. The Nature of the chemical bond (Cornell University Press) ISBN 0-8014-0333-2
- Pauling, L., and Wilson, E. B. Introduction to Quantum Mechanics with Applications to Chemistry (Dover Publications) ISBN 0-486-64871-0
- Smart and Moore Solid State Chemistry: An Introduction (Chapman and Hall) ISBN 0-412-40040-5
- Stephenson, G. Mathematical Methods for Science Students (Longman) ISBN 0-582-44416-0
- Charles E. Mortimer: Chemie – Das Basiswissen der Chemie. Thieme, Stuttgart 2003, ISBN 3-13-484308-0.
- Joachim Kranz, Manfred Kuballa: Chemie im Alltag. Cornelsen Scriptor, Berlin 2003, ISBN 3-589-21692-1.
- Pedro Cintas: Der Weg zu chemischen Namen und Eponymen: Entdeckung, Priorität und Würdigung. In: Angewandte Chemie. 116(44) (2004), ISSN 0044-8249, S. 6012–6018.
- Wächter, Michael: Tabellenbuch der Chemie. Daten zur Analytik, Laborpraxis und Theorie, Wiley-VCH, Weinheim 2012, 1. Aufl., ISBN 978-3-527-32960-1
- Mendeleev D. I. Periodičeskiй zakon: V 3 t. na saйte Runivers
- Nekrasov B. V. Osnovы obщeй himii, t. 1. — M.: «Himiя», 1973
- Himičeskaя эnciklopediя, p. red. Knunяnc I. L., t. 5. — M.: «Sovetskaя эnciklopediя», 1988
- Himiя: Sprav. izd./ V. Šreter, K.-H. Lautenšleger, H. Bibrak i dr.: Per. s nem. — M.: Himiя, 1989
- Džon Mur. (2011). Himiя dlя čaйnikov. M.: Dialektika. ISBN 978-5-8459-1773-7.
- N. L. Glinka.. Obщaя himiя. M.: Integral-Press. ISBN 5-89602-017-1.
- Džua M. (1966). Istoriя himii. Mir. str. 452.
- Dubinskaя A. M., Prizment Э. L. Himičeskie эnciklopedii, v kn.: Himičeskiй эnciklopedičeskiй slovarь. — M., 1983
- Potapov V. M., Kočetova Э. K. Himičeskaя informaciя. Gde i kak iskatь himiku nužnыe svedeniя. — M., 1988
- Kuznecov, Vladimir Ivanovič Obщaя himiя: tendencii razvitiя. M.: Vыsšaя škola, 1989.
Vanjske veze
| U Wikimedijinoj ostavi nalazi se članak na temu: Chemistry | |
| Potražite izraz hemija u W(j)ečniku, slobodnom rječniku. |



















