Infrastructure tools to support an effective radiation oncology learning health system
Contenidos
| |||
| Nombres | |||
|---|---|---|---|
| Semisistemático
Oxaldehído | |||
| Nombre IUPAC sistemático
Etanodial | |||
| Otros nombres
Glioxal
Oxalaldehído | |||
| Identificadores | |||
| |||
Modelo 3D (JSmol)
|
|||
| ChEBI | |||
| ChemSpider |
| ||
| ECHA InfoCard | 100.003.160 | ||
| KEGG |
| ||
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|||
| UNII | |||
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|||
| |||
| |||
| Propiedades | |||
Fórmula
|
C2H2O2 | ||
| Masa molar | 58.036 g·mol−1 | ||
| Densidad | 1.27 g/cm³ | ||
| Punto de fusión | 15 °C (59 °F; 288 K) | ||
| Punto de ebullición | 51 °C (124 °F; 324 K) | ||
| Termoquímica | |||
Capacidad calorífica (C)
|
1.044 J/(K·g) | ||
| Riesgos a la salud | |||
| NFPA 704 | |||
| Punto de ignición | −4 °C (25 °F; 269 K) | ||
| 285 °C (545 °F; 558 K) | |||
| Relacionó compuestos | |||
Aldehídos relacionados
|
Acetaldehído
Glicolaldehído Propanodial Metilglioxal | ||
Compuestos relacionados
|
Ácido oxálico Ácido glioxálico Ácido glicólico | ||
Excepto en los casos en donde se indique, el dato está dado para materiales en su estado estándar (en 25 °C [77 °F], 100 kPa). | |||
| Y | |||
| Infobox Referencias | |||
El Glioxal es un compuesto orgánico con la fórmula química OCHCHO. Es el dialdehído más pequeño (un compuesto con dos grupos de aldehído) y es el único caso en donde un sustituyente formilo se encuentra conectado a otro. Es un sólido cristalino , blanco en temperaturas bajas y amarillos se acerca el punto de fundir (15 °C). El líquido es amarillo, y el vapor es verde.[1]
El glioxal puro no se encuentra comúnmente porque forma hidratos, los cuales oligomerizan. Para muchos propósitos, estos oligómeros hidratados se comportan de manera equivalente al glioxal. Se produce industrialmente como un precursor de muchos productos.[2]
Producción
El glioxal fue preparado y nombrado por primera vez por el químico germano-británico Heinrich Debus (1824–1915) mediante la reacción del etanol con ácido nítrico.[3]
El glioxal comercial se prepara mediante la oxidación en fase gaseosa del etilenglicol en presencia de un catalizador de plata o cobre (el proceso de Laporte) o mediante la oxidación en fase líquida del acetaldehído con ácido nítrico.[2]
La primera fuente comercial de glioxal en Lamotte,, Francia, comenzó en 1960. La fuente comercial más grande es BASF en Ludwigshafen, Alemania, con alrededor de 60,000 toneladas por año. También existen otros sitios de producción en los Estados Unidos y China. El glioxal a granel comercial se fabrica y se reporta como una solución de 40% en agua.[4][5][3]
El glioxal se puede sintetizar en laboratorio por oxidación del acetaldehído con ácido selenoso.[6]
El glioxal anhidro se prepara calentando los hidratos de glioxal sólido con pentóxido de fósforo y condensando los vapores en una trampa fría.[7]
La constante de ley del Henry experimentalmente determinado de glioxal es:
- KH = 4.19 × 105 × exp[62.2 × 103R × (1T − 1298)].[8][aclaración requerida]
Aplicaciones
El papel recubierto y los acabados textiles utilizan grandes cantidades de glioxal como reticulante para formulaciones basadas en almidón. Se condensa con la urea para obtener la 4,5-dihidroxi-2-imidazolidinona, que reacciona más con el formaldehído para dar el derivado de bis (hidroximetil) dimetilol etilenurea, que se usa para tratamientos químicos resistentes a las arrugas de la ropa, es decir, planchado permanente.
El glioxal se utiliza como solubilizador y agente reticulación en química de polímeros.
El glioxal es un precursor valioso en síntesis orgánica, especialmente en la síntesis de heterociclos tales como los imidazoles.[9] Una forma conveniente del reactivo para su uso en el laboratorio es su bis(hemiacetal) con etilenglicol, (1,4-dioxane-2,3-diol). Este compuesto es comercialmente disponible.
Las disoluciones de glioxal también pueden ser utilizadas como fijadores en histología.
El glioxal y sus derivados también se utilizan en el sondeo químico de la estructura del ARN, ya que reaccionan con guaninas libres en los ARN.[10]
Especiación en solución
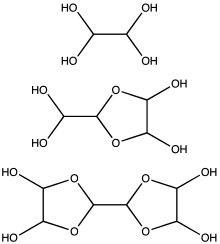
El glioxal se emplea típicamente como una disolución acuosa al 40%.[2] al igual que otros aldehídos, el glioxal tiende a formar hidratos. Estos compuestos se condensan para dar una serie de oligómeros, algunos del cual presentande estructura incierta. Para más aplicaciones, la naturaleza exacta de la especie en solución es intrascendente. Se comercializa al menos un hidrato de glioxal, el trímero dihidrato: [(CHO)2]3(H2O)2 (CAS 4405-13-4).Otros equivalentes del glioxal se encuentran disponibles en el mercado, como el hemiacetal etilenglicólico 1,4-dioxano-trans-2,3-diol (CAS 4845-50-5, p.f. 91–95 °C).
Se ha estimado que, a concentraciones menores de 1 M, el glioxal existe predominantemente como el monómero o hidratos del mismo, por ejemplo, OCHCHO, OCHCH(OH)2, o (HO)2CHCH(OH)2. En concentraciones arriba de 1 M, predominan los dímeros. Estos dímeros son probablemente los dioxolanos, con la fórmula [(HO)CH]2O2CHCHO.[11] El dímero y los trímeros precipitan como sólidos de soluciones frías.
El glioxal ha sido observado como gas traza en la atmósfera, p. ej. como un producto de oxidación de hidrocarburos.[12] Se han reportado concentraciones troposféricas de 0–200 ppt por volumen, mientras que en regiones contaminadas se púede encontrar hasta a 1 ppb por volumen.[13]
Seguridad
La LD50 (oral, ratas) es 3300 mg/kg, el cual es muy alto.[2]
Referencias
- ↑ O'Neil, M.J. (2001): The Merck Index, 13th Edition, page 803.
- ↑ a b c d Mattioda, Georges; Blanc, Alain. "Glyoxal". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a12_491.pub2. ISBN 978-3527306732.
- ↑ a b Henry Enfield Roscoe and Carl Schorlemmer, A Treatise on Chemistry, vol. 3 (New York, New York: D. Appleton and Co., 1890), pp. 101-102.
- ↑ H. Debus (1857) "On the action of nitric acid on alcohol at common temperatures," Philosophical Magazine, 4th series, 13 : 39–49. From p. 40 : "This residue consisted almost entirely of the aldehyde of glyoxylic acid ; I proposed to call it Glyoxal, C2H4O3
- ↑ H. Debus (1857) "On glyoxal," Philosophical Magazine, 4th series, 13 : 66.
- ↑ (1944) "Glyoxal Bisulfite". Org. Synth. 24: 61; Coll. Vol. 3: 438.
- ↑ Harries, C.; Temme, F. (1907). «Über monomolekulares und trimolekulares Glyoxal» [On monomoleular and trimoecular glyoxal]. Berichte 40 (1): 165-172. doi:10.1002/cber.19070400124. «Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühlten Vorlage zu schönen Krystallen von gelber Farbe kondensiert. [One heats the mixture of (crude) glyoxal and P4O10 with an open flame and soon observes, upon blackening of the contents, a mobile green gas which condenses in the cooled flask as beautiful yellow crystals.]».
- ↑ Ip, H. S.; Huang, X. H.; Yu, J. Z. (2009). «Effective Henry's law constants of glyoxal, glyoxylic acid, and glycolic acid». Geophys. Res. Lett. 36 (1): L01802. Bibcode:2009GeoRL..36.1802I. doi:10.1029/2008GL036212.
- ↑ (1942) "Imidazole". Org. Synth. 22: 65; Coll. Vol. 3: 471.
- ↑ Mitchell, D; Ritchey, L; Park, H; Babitzke, P; Assmann, S; Bevilacqua, P (2017). «Glyoxals as In Vivo RNA Structural Probes of Guanine Base Pairing». RNA 24: 114-124. PMC 5733565. doi:10.1261/rna.064014.117.
- ↑ Whipple, E. B. (1970). «Structure of Glyoxal in Water». J. Am. Chem. Soc. 92 (24): 7183-7186. doi:10.1021/ja00727a027.
- ↑ Vrekoussis, M.; Wittrock, F.; Richter, A.; Burrows, J. P. (2009). «Temporal and spatial variability of glyoxal as observed from space». Atmos. Chem. Phys. 9 (13): 4485-4504. doi:10.5194/acp-9-4485-2009.
- ↑ Volkamer, Rainer (2007). «A missing sink for gas‐phase glyoxal in Mexico City: Formation of secondary organic aerosol». Geophys. Res. Lett. 34 (19): 19. Bibcode:2007GeoRL..3419807V. doi:10.1029/2007gl030752.