FAIR and interactive data graphics from a scientific knowledge graph
Innhold

I atomfysikk og kvantekjemi refererer elektronkonfigurasjon til hvordan elektronene er gruppert i et atom, molekyl, eller en annen fysisk struktur. I likhet med andre elementærpartikler er elektronets oppførsel beskrevet av kvantefysikkens lover, og framviser både partikkelegenskaper og bølgeegenskaper. Formelt er kvantetilstanden til et elektron definert ved dets bølgefunksjon, en kompleks funksjon i rom og tid. Ifølge Københavntolkningen av kvantemekanikken er ikke posisjonen til et enkelt elektron veldefinert før den måles. Sannsynligheten for at målingen av posisjonen til elektronet gir et visst punkt i rommet er proporsjonal med kvadratet av absoluttverdien av bølgefunksjonen i det punktet.
Elektroner kan bevege seg fra et energinivå til et annet ved å emittere eller absorbere et energikvant i form av et foton. Pauliprinsippet gir at ikke mer enn to elektroner kan eksistere i samme kvantetilstand; derfor kan et elektron bare hoppe til en annen bane bare dersom det er en ledig tilstand i den nye orbitalen.
Kjennskap til elektronkonfigurasjonen til mange atomer er nyttig i forståelsen av strukturen til det periodiske system. Konseptet er også nyttig til å beskrive de kjemiske bindingene som holder atomer sammen, og forklare egenskapene til laserstråling og halvledere.
Elektronkonfigurasjon i atomer
Denne diskursen forutsetter kjennskap til materialet som finnes i atomær orbital
Sammendrag av kvantetallene
Tilstanden til et elektron er gitt av fire kvantetall. Tre av disse er heltall og er egenskaper til den atomære orbitalen elektronet befinner seg i.
| tall | markert som | lovlige verdier | representerer |
|---|---|---|---|
| hovedkvantetall | n | heltall, 1 eller større | Delvis den totale energien til orbitalen, og derav dens generelle avstand fra kjernen. Kort sagt, tilstandens energinivå (1+) |
| asimutalt kvantetall | l | heltall, 0 til n-1 | Orbitalens dreieimpuls, også sett på som antall noder i tetthetskurven. Også kjent som tilstandens orbital. (s=0, p=1...) |
| magnetisk kvantetall | m | heltall, -l til +l, inkludert null. | Bestemmer energiforskyvningen til en atomær orbital som påføres av et ytre magnetfelt (Zeemaneffekten). Indikerer tilstandens orientering i rommet. |
| spinnkvantetall | s | +½ or -½ (iblant kalt "opp" og "ned") | Spinn er en indre egenskap ved elektronet som er uavhengig av de andre kvantetallene. Elektronets magnetiske dipolmoment bestemmes blant annet av s og l. |
Minst ett av kvantetallene må være forskjellige for to elektroner (Pauliprinsippet).
Skall og orbitaler
Skall og underskall (også kalt energinivåer og undernivåer) defineres av kvantetallene, ikke av elektronenes avstand fra kjernen eller deres totale energi. I store atomer vil skallene ofte overlappe.
Tilstander med samme n-verdi er beslektet, og man sier at de ligger i samme elektronskall.
Tilstander med samme n- og l-verdier sier man at ligger i samme underskall eller orbital. De elektronene som har samme n- og l-verdier, kalles ekvivalente elektroner.
Hvis tilstander også har samme m-verdi, må spinntilstanden være forskjellig ifølge Pauliprinsippet.
En orbital kan inneholde så mye som 4l + 2 elektroner; et skall kan inneholde opptil 2n2 elektroner.
Eksempel
Her vises elektronkonfigurasjonen for et fylt femte skall:
| Skall | Underskall | Orbitaler | Elektroner | |
|---|---|---|---|---|
| n = 5 | l = 0 | m = 0 | → 1 type s-orbital | → maks 2 elektroner |
| l = 1 | m = -1, 0, +1 | → 3 type p-orbitaler | → maks 6 elektroner | |
| l = 2 | m = -2, -1, 0, +1, +2 | → 5 type d-orbitaler | → maks 10 elektroner | |
| l = 3 | m = -3, -2, -1, 0, +1, +2, +3 | → 7 type f-orbitaler | → maks 14 elektroner | |
| l = 4 | m = -4, -3 -2, -1, 0, +1, +2, +3, +4 | → 9 type g-orbitaler | → maks 18 elektroner | |
| Totalt: maks 50 elektroner |
Denne informasjonen kan skrives som 5s2 5p6 5d10 5f14 5g18 (Se nedenfor for flere detaljer angående notasjon)
Notasjon
Fysikere og kjemikere bruker en standardnotasjon for å beskrive atomære elektronkonfigurasjoner. I slik notasjon er et underskall skrevet på formen nxy, der n er skallnummeret, x er underskallmarkøren (s, p, d, f, g, h, i), og y er antall elektroner i underskallet. Et atoms underskall skrives i stigende energirekkefølge – med andre ord, i den rekkefølgen skallene fylles i. (Se Aufbauprinsippet nedenfor).
For eksempel: Hydrogen i grunntilstanden har ett elektron i s-orbitalen til det første skallet, så konfigurasjonen skrives 1s1. Litium har to elektroner i 1s-underskallet og ett i 2s-underskallet (som har høyere energi), så dets grunntilstandkonfigurasjon skrives 1s2 2s1. Fosfor (atomnummer 15), har følgende grunntilstandskonfigurasjon: 1s2 2s2 2p6 3s2 3p3.
Denne notasjonen kan være upraktisk for atomer med mange elektroner. Man innfører dermed edelgassnotasjon. Den forkortes ofte ved å legge merke til at de første underskallene er identiske med de tilsvarende underskallene for en eller annen edelgass. Fosfor, for eksempel, er kun forskjellig fra neon (1s2 2s2 2p6) ved at fosfor har et tredje skall. Man trekker da ut elektronkonfigurasjonen til neon, og skriver fosfor som følger: [Ne]3s2 3p3.
En enda enklere versjon er simpelthen å angi antall elektroner i hvert skall, f.eks. (igjen for fosfor): 2-8-5.
Orbitalmarkørene s, p, d, og f har sin opprinnelse i en måte å kategorisere spektrallinjer på, som nå er gått bort fra. I dette systemet ble spektrallinjene kategorisert som skarp, prinsipal, diffus, og fundamental basert på deres observerte finstruktur. Da de fire første orbitaltypene ble beskrevet, ble de assosiert med disse spektrallinjetypene, men det fantes ingen andre navn. Markøren g ble utledet ved å fortsette i alfabetisk rekkefølge. Det er teoretisk mulig med skall som inneholder fler enn fem underskall, men disse fem dekker alle til nå oppdagede elementer.
Aufbauprinsippet
I atomets grunntilstand (der atomet vanligvis er å finne) følger elektronkonfigurasjonen generelt Aufbauprinsippet. Dette prinsippet forteller at måten elektroner fyller skall på er i stigende energirekkefølge; altså, det første elektronet går inn i den laveste energitilstanden, det andre i den nest laveste, og så videre. Fyllingsrekkefølgen er som følger:
| 1 | 1 | ||||
|---|---|---|---|---|---|
| 2 | 2 | 3 | |||
| 3 | 4 | 5 | 7 | ||
| 4 | 6 | 8 | 10 | 13 | |
| 5 | 9 | 11 | 14 | 17 | 21 |
| 6 | 12 | 15 | 18 | 22 | |
| 7 | 16 | 19 | 23 | ||
| 8 | 20 | 24 |
Hvilken rekkefølge underskallene kommer i kan finnes ved å begynne øverst til venstre (i de ikke-fete tallene) i tabellen og gå gjennom venstre-nedover-diagonaler (se også diagrammet øverst på siden). De fete tallene angir da skallnummeret, mens de ikke uthevede tallene angir rekkefølgen skallene fylles opp i. Den første diagonalen gir da 1s; den neste gir 2s; den tredje går gjennom 2p og 3s; den fjerde gjennom 3p og 4s; den femte gjennom 3d, 4p og 5s, og så videre. Generelt vil et underskall som ikke er et «s»-skall alltid følges av et «lavere» underskall i det neste skallet; for eksempel følges 2p av 3s; 3d følges av 4p, som følges av 5s; og så videre. Dette forklarer blokkene i det periodiske system.
Et elektronpar som har spinn i samme retning har litt lavere energi enn et par med motsatt rettede spinn. Siden to elektroner i samme orbital må ha motsatt rettede spinn, foretrekker elektroner å okkupere forskjellige orbitaler. Denne preferansen vises hvis underskall med l>0 (altså som inneholder mer enn en orbital) ikke er helt fylt. For eksempel, hvis et p-underskall inneholder fire elektroner vil to elektroner tvinges til å okkupere en orbital, men de to andre elektronene okkuperer begge de to andre orbitalene, og spinnene deres vil peke i samme retning. Dette fenomenet kalles Hunds regel.
Aufbauprinsippet i en modifisert versjon kan anvendes på protoner og nøytroner i atomkjernen. (Se skallmodellen i kjernefysikk).
Orbitaltabell
Denne tabellen viser alle orbitalkonfigurasjoner opp til 7s; derfor dekker den den enkle elektronkonfigurasjonen for alle elementer i det periodiske system opp til Copernicium (element 112) med unntak av Lawrencium (element 103) som behøver en 7p-orbital.
| s (l=0) | p (l=1) | d (l=2) | f (l=3) | |
|---|---|---|---|---|
| n=1 | 
|
|||
| n=2 | 
|

|
||
| n=3 | 
|

|

|
|
| n=4 | 
|
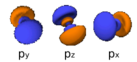
|

|

|
| n=5 | 
|

|

|
|
| n=6 | 
|

|
||
| n=7 | 
|
Unntak i 3d, 4d, 5d
Et d-underskall som er halvfullt (5 eller 10 elektroner) er mer stabilt enn s-underskallet som tilhører neste skall. Dette er tilfellet fordi det krever mindre energi å holde et elektron i et halvfullt d-underskall enn et fullt s-underskall. Kobber(atomnummer 29), for eksempel, har konfigurasjonen [Ar]4s1 3d10, ikke [Ar]4s2 3d9 som man skulle tro ved å anvende Aufbauprinsippet. På samme måte har krom (atomnummer 24) konfigurasjonen [Ar]4s1 3d5, ikke [Ar]4s2 3d4.
Unntak i Periode 4:
| Element | Z | Elektronkonfigurasjon | Edelgasskonfigurasjon |
|---|---|---|---|
| Scandium | 21 | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 | [Ar] 4s2 3d1 |
| Titanium | 22 | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | [Ar] 4s2 3d2 |
| Vanadium | 23 | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 | [Ar] 4s2 3d3 |
| Krom | 24 | 1s2 2s2 2p6 3s2 3p6 4s1 3d5 | [Ar] 4s1 3d5 |
| Mangan | 25 | 1s2 2s2 2p6 3s2 3p6 4s2 3d5 | [Ar] 4s2 3d5 |
| Jern | 26 | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 | [Ar] 4s2 3d6 |
| Kobolt | 27 | 1s2 2s2 2p6 3s2 3p6 4s2 3d7 | [Ar] 4s2 3d7 |
| Nikkel | 28 | 1s2 2s2 2p6 3s2 3p6 4s2 3d8 | [Ar] 4s2 3d8 |
| Kobber | 29 | 1s2 2s2 2p6 3s2 3p6 4s1 3d10 | [Ar] 4s1 3d10 |
| Sink | 30 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 | [Ar] 4s2 3d10 |
| Gallium | 31 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1 | [Ar] 3d10 4s2 4p1 |
Unntak i Periode 5:
| Element | Z | Elektronkonfigurasjon | Edelgasskonfigurasjon |
|---|---|---|---|
| Yttrium | 39 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1 | [Kr] 5s2 4d1 |
| Zirkonium | 40 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 | [Kr] 5s2 4d2 |
| Niob | 41 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4 | [Kr] 5s1 4d4 |
| Molybden | 42 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 | [Kr] 5s1 4d5 |
| Technetium | 43 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 | [Kr] 5s2 4d5 |
| Ruthenium | 44 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7 | [Kr] 5s1 4d7 |
| Rhodium | 45 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8 | [Kr] 5s1 4d8 |
| Palladium | 46 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 | [Kr] 4d10 |
| Sølv | 47 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 | [Kr] 5s1 4d10 |
| Kadmium | 48 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 | [Kr] 5s2 4d10 |
| Indium | 49 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 | [Kr] 5s2 4d10 5p1 |
Unntak i Periode 6:
| Element | Z | Edelgasskonfigurasjon |
|---|---|---|
| Iridium | 77 | [Xe] 6s2 4f14 5d7 |
| Platina | 78 | [Xe] 6s1 4f14 5d9 |
| Gull | 79 | [Xe] 6s1 4f14 5d10 |
| Kvikksølv | 80 | [Xe] 6s2 4f14 5d10 |
| Thallium | 81 | [Xe] 6s2 4f14 5d10 6p1 |
Sammenhengen med periodesystemets struktur
Elektronkonfigurasjon har nær sammenheng med periodesystemets struktur. De kjemiske egenskapene til et atom bestemmes stort sett av hvordan elektronene i dets ytre valensskall er arrangert (selv om andre faktorer, som atomradien, atommassen, og økt tilgang til flere elektrontilstander, også påvirker den kjemiske oppførselen til elementene ved økende atomstørrelse), og derfor er elementer i samme gruppe kjemisk like fordi de har samme antall valenselektroner.
Elektronkonfigurasjon i molekyler
I molekyler er situasjonen mer kompleks, da hvert molekyl har forskjellig orbitalstruktur.
Elektronkonfigurasjon i faste stoffer
I et fast stoff er det svært mange elektrontilstander. De opphører da å være tellbare, og blandes sammen slik at de utgjør et kontinuerlig bånd av tilstander. Elektronkonfigurasjon slutter da å være relevant, og båndteori må da brukes for å forklare egenskapene til stoffet.






















